NRF2-KEAP1信号通路上,期待肿瘤抑制因子GULP1乘风破浪
Posted bioSeedin柏思荟
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了NRF2-KEAP1信号通路上,期待肿瘤抑制因子GULP1乘风破浪相关的知识,希望对你有一定的参考价值。
△ 8月29-30日,2020BDIC将在上海新华联索菲特酒店举行,请长按二维码进入大会官网,点击“购票”,即可报名。
当前,膀胱尿路上皮癌(UCB)可分为肌肉浸润性UCB(MIUCB)和非肌肉浸润性UCB(NMIUCB)。对于NMIUCB,标准的治疗方法是经尿道切除术,然后使用化疗药物或经膀胱给药卡介苗芽孢杆菌,而MIUCB患者一般采用膀胱切除术,或伴随辅助化疗。然而,总体生存率因肿瘤分期的不同而存在很大差异,且治疗方案有限。
因此,患者迫切需要一种新型的治疗方案来有效提高膀胱癌患者的生存结局。由此衍生了NRF2抑制剂结合标准化疗方案。然而,NRF2激活因子在人体正常的情况下同时存在有益的生理作用,过度抑制更会适得其反。因此,对GULP1-NRF2-KEAP1信号通路的进一步拓展研究,评估其在肿瘤发生中的作用则显得尤其重要。
来自美国约翰霍普金斯大学的研究人员与人工智能药物研发公司Insilico Medicine合作,在2020年8月18日的Science 子刊Science Signaling期刊上,发表了一篇标题为“GULP1 regulates the NRF2-KEAP1 signaling axis in urothelial carcinoma”的研究论文,深入探究GULP1-KEAP1- NRF2信号通路在UCB中的发生改变,发现GULP1是一个潜在的肿瘤抑制因子,通过增强KEAP1的稳定性及其在NRF2细胞质支架中的功能来调控NRF2通路。
GULP1(含吞噬衔接蛋白1的PTB结构域)是CED6(Caenorhabditis elegans death-6)的人类同源物,具有促进人巨噬细胞吞噬的作用,能够通过CED1激活下游信号。目前,已有报道GULP1的改变与包括癌症在内的不同病理生理条件相关。
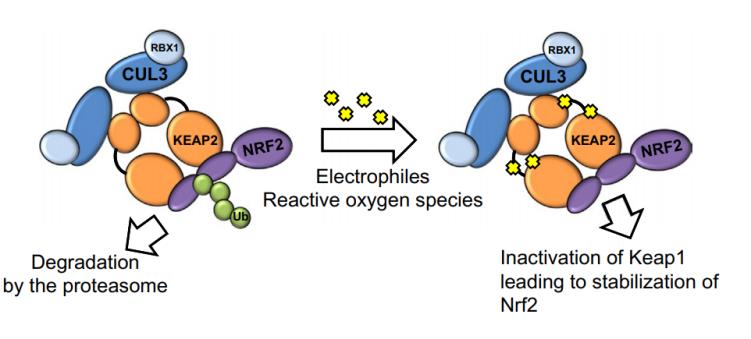
我们知道,由吸烟引发的活性氧(ROS)可引起膀胱的氧化应激和组织损伤,而KEAP1-NRF2信号通路对ROS解毒和细胞保护至关重要。NRF2是一种转录因子,在正常条件下,在GULP1蛋白的参与下,NRF2可与KEAP1结合,从而与肌动蛋白细胞骨架结合,隔离在细胞质中。然而,基因的改变会导致KEAP1活性的丧失,进而使得NRF2激活。在许多实体癌中,这两种效应都会诱导下游的肿瘤细胞保护反应。与KEAP1-NRF2信号通路不同,关于探究GULP1的生物学功能及其基因或表观遗传调控表达的信息还很少。
GULP1启动子高甲基化导致基因沉默,抑制肿瘤生长
首先,研究者们通过免疫组化分析表明了GULP1在侵袭性UCB组织中常常不表达。为了了解GULP1改变引发的生物学变化,团队检测了GULP1在RNA和蛋白水平上的表达,分析了在体外和体内两种条件下,通过对UCB组织中过表达GULP1和敲除GULP1的两种处理来分析肿瘤的生长情况。结果表明,GULP1具有抑制肿瘤生长抑制的特征。
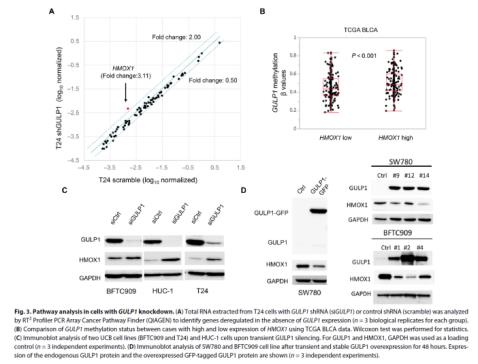
接着,研究团队进一步了解了GULP1在UCB中的作用。与对照组相比,编码血红素氧合酶-1的HMOX1在GULP1敲除的T24细胞中表达增加了3倍多,且高HMOX1表达与GULP1启动子高甲基化(导致基因沉默)显著相关。而过度表达GULP1则导致HMOX1蛋白质水平明显降低,进一步证实了在UCB中GULP1和HMOX1之间的负相关,与血红素加氧酶-1表达呈负相关。
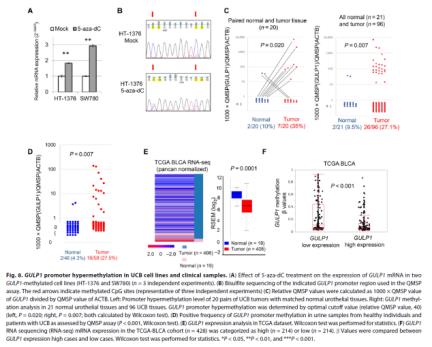
此外,为了探究GULP1在UCB组织中的表达减弱与GULP1启动子甲基化的关系,团队对6份UCB样本进行了免疫组化染色并进行分析,结果显示GULP1沉默与启动子甲基化负相关。此外,研究者们还通过分析76个不同阶段和分级的原发肿瘤GULP1启动子甲基化情况以及使用TCGA BLCA数据集,验证了UCB中GULP1启动子甲基化的情况,结果均一致,与正常对照组相比,肿瘤样本中GULP1的表达显著降低,GULP1低表达的肿瘤中启动子显著高甲基化。
GULP1与KEAP1-肌动蛋白复合物相互作用以调节NRF2信号
GULP1是可以与KEAP1结合共同维持肌动蛋白的细胞骨架结构的蛋白,而HMOX1的表达受转录激活因子NRF2的正向调控。那么GULP1又是如何与KEAP1相互作用来启动KEAP1-NRF2通路呢?
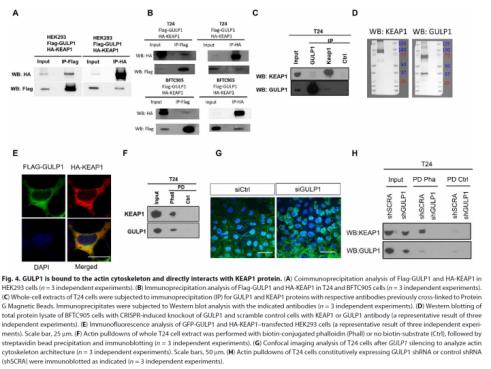
分析显示,在GULP1存在的情况下,内源性KEAP1和GULP1都单独结合到肌动蛋白细胞骨架上,相反,在没有GULP1的情况下,却未能检测到与肌动蛋白复合物结合的KEAP1蛋白。综合结果证明,GULP1在肌动蛋白细胞骨架的完整性中发挥重要作用,是与KEAP1相互作用的蛋白,参与KEAP1-NRF2信号转导通路的调控。
此外,GULP1蛋白主要定位在细胞质中,那么GULP1是否会影响NRF2的定位,NRF2会是否会通过动态的亚细胞定位影响HMOX1的激活?在UCB中,GULP1的沉默促进了NRF2的核积累,NRF2的核定位和积累会引发依赖NRF2的转录激活和下游基因表达的增加,导致NRF2信号的组成性激活。
研究结果表明,GULP1的敲除增强了NRF2在细胞核中的易位和积累,而GULP1过表达导致细胞核中NRF2降低。同时,当GULP1表达缺失时,HMOX1启动子报告基因的活性增加,这表明NRF2信号在没有GULP1的情况下会被激活,从而激活其下游靶基因。综合结果显示,GULP1的表达状态是NRF2核定位的部分决定因素,并帮助KEAP1在细胞质中隔离NRF2,GULP1的抑癌功能部分是通过抑制KEAP1- NRF2信号通路介导的。
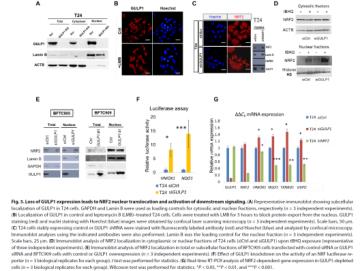
KEAP1功能缺失会导致肿瘤细胞中NRF2介导的基因表达激活,从而操纵NRF2通路抗衡化疗药物并存活。根据上述的结果,GULP1是KEAP1的同盟,可以结合调控NRF2及其下游信号,那么GULP1的沉默是否可能与顺铂(CDDP)耐药有关?
正如预期,研究者观察到,与对照组相比,在CDDP耐药的T24细胞中,内源性GULP1的表达在蛋白和转录水平上均有所降低,而低表达的GULP1使得耐药的T24细胞的存活率提高,这表明GULP1沉默与CDDP耐药有关。接着,研究者发现内源性GULP1高表达的细胞株比表达低的细胞株对CDDP更敏感,被敲除GULP1的细胞在高浓度CDDP环境下表现出更大的生存能力。
为了进一步探讨GULP1沉默和化疗应答的临床相关性,研究者通过QRT-PCR分析了在UCB的一个小临床队列中GULP1的表达,该队列包括9个CDDP无应答者和6个CDDP有应答者。与细胞系数据相一致的是,在大多数CDDP无应答的病例中,观察到GULP1低表达或不表达。
目前,对于膀胱尿路上皮癌患者而言,使用尿液识别具有高灵敏度和高特异性的非侵入性、低成本的生物标记物是治疗UCB的必要条件。此外,更是迫切需要一种可以确定化疗耐药性的预测性生物标志物,以确定对特定患者的最佳治疗方案,GULP1也可能将会是一个理想的检测目标。
虽然KEAP1-NRF2通路是膀胱癌和其他实体恶性肿瘤的主要信号通路,研发靶向这一复杂通路的治疗方案仍然具有挑战性,但越来越多的谜题已被我们揭开,相信不久的将来,膀胱癌患者会迎来新的治疗曙光!
Masamichi Hayashi et al. GULP1 regulates the NRF2-KEAP1 signaling axis in urothelial carcinoma. Science Signaling, 2020, doi:10.1126/scisignal.aba0443.
生物药开发者创新大会Biopharma Developer Innovation Conference(简称BDIC)是由生物医药年轻厂牌bioSeedin柏思荟于2019年发起创办的生物药研发人员年度盛会。旨在凝聚国内外生物药创新力量,探讨生物药前沿技术,推动中国新药创新与发展。
生物药开发者创新大会基于bioseedin柏思荟线下workshop而来,bioSeedin workshop专注聚焦抗体药领域(2020年新开设细胞治疗板块),提供全面、专业、阶梯式的知识分享,目前已覆盖100+知名药企,500+研发人员。嘉宾4小时不间断分享、观众可以随时发问,已经成为了workshop的口碑和特色。2年多的积累下来,收获一波粉丝团——百香果,也顺势造就了生物药开发者创新大会。
以上是关于NRF2-KEAP1信号通路上,期待肿瘤抑制因子GULP1乘风破浪的主要内容,如果未能解决你的问题,请参考以下文章
如何从肿瘤免疫应答的角度设计研究思路?
ASCO更新乳腺癌指南;mCRPC患者雄激素受体抑制剂耐药颓势有望得到逆转|肿瘤情报
肌电信号基于matlab低通滤波肌电信号处理含Matlab源码 964期
肌电信号基于matlab低通滤波肌电信号处理含Matlab源码 964期
肿瘤构建自己神经网络的机制:轴突新生+神经新生
百科知识 对讲机原理