功能基因组学的预测网络模型识别炎症性肠病的调节因子
Posted 严海丹生信组文献
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了功能基因组学的预测网络模型识别炎症性肠病的调节因子相关的知识,希望对你有一定的参考价值。
题目英文:A functional genomics predictive network model identifies regulators of inflammatory bowel disease
题目中文:功能基因组学的预测网络模型识别炎症性肠病的调节因子
发表时间:2017年9月11日 杂志:Nature Genetics 影响因子:27.125
摘要英文:A major challenge in inflammatory bowel disease (IBD) is the integration of diverse IBD data sets to construct predictive models of IBD. We present a predictive model of the immune component of IBD that informs causal relationships among loci previously linked to IBD through genome-wide association studies (GWAS) using functional and regulatory annotations that relate to the cells, tissues, and pathophysiology of IBD. Our model consists of individual networks constructed using molecular data generated from intestinal samples isolated from three populations of patients with IBD at different stages of disease. We performed key driver analysis to identify genes predicted to modulate network regulatory states associated with IBD, prioritizing and prospectively validating 12 of the top key drivers experimentally. This validated key driver set not only introduces new regulators of processes central to IBD but also provides the integrated circuits of genetic, molecular, and clinical traits that can be directly queried to interrogate and refine the regulatory framework defining IBD.
摘要中文:炎症性肠病(IBD)的主要挑战在于整合各种IBD数据集以构建IBD预测模型。我们提出了IBD免疫成分的预测模型。该模型通过使用IBD相关的细胞,组织和病理生理学的功能性和调节性注释信息,从而对揭示在先前全基因组关联研究(GWAS)中与IBD相关的基因座之间的因果关系。从三个处于不同疾病阶段的IBD患者队列中获取分子数据,构建出由独立网络组成的模型。我们进行了关键驱动因素分析,以鉴定出那些可以预测与IBD相关的网络调节状态的基因,并对这些基因进行排序以及通过实验对12个最关键的驱动因素进行前瞻性验证。这种经过验证的关键驱动基因集不仅引入了IBD核心过程新的调节器,而且还提供了遗传,分子和临床特征的集成网络,可以直接查询这些特性来询问和完善IBD的调控框架。
背景中文:
克罗恩病(CD)和溃疡性结肠炎(UC)是IBD的主要形式,其特征是肠道炎症复发和缓解。虽然克罗恩病和溃疡性结肠炎的具有不同的临床表型和仅重叠一些分子途径,但它们在很大程度上具有共同的遗传结构。尽管GWAS已鉴定出200多个与IBD相关的基因座,但这些已知的遗传变异仅贡献了约26%的克罗恩病和19%的溃疡性结肠炎的遗传性。
通过构建因果网络模型,可以对大规模、多样的数据进行整合利用,统计推断出任何感兴趣特征之间的因果关系,从而全面描述IBD的结构。已经证明IBD相关基因可以组织形成显著富集免疫和炎症过程的调节网络。
然而,目前为止,还没有从IBD相关组织以及不同IBD疾病阶段的分子状态构建的IBD网络模型。因此,本文整合IBD不同疾病阶段的大规模DNA和RNA数据,以构建IBD病理性炎症成分模型,这有助于区分与IBD相关的炎症成分和肠道的稳态背景功能。
方法中文:(重点描述清楚数据及数据来源)
1)表达数据来自以下三个数据集,并从RNA-seq中鉴定遗传变异。
数据队列 |
样本数量 |
来源 |
备注 |
RISK |
322 |
GSE57945 |
回肠活检样本,包括CD、UC以及control |
CERTIFI |
118 |
GSE100833 |
抗肿瘤坏死因子(TNF)-α治疗无效的CD患者样本,包括多个肠段 |
MSH |
134 |
GSE83687 |
晚期IBD患者样本,多个肠段,包括CD、UC以及control(control取自散发性结肠癌患者正常非炎症肠) |
2)从International Inflammatory Bowel Disease Genetics Consortium (IIBDGC)和Immunochip研究获得CD、UC和IBD基因座(GWAS);整合先前发表的IBD、免疫以及消化相关的eQTL数据集;通过ENCODE、REMC、FANTOM5以及Roadmap的Chip-seq以及DHS-seq等获得不同细胞类型(参与免疫和消化过程)的细胞类型特异性顺式调节元件(CRE)。
3)本文通过获得保守炎症成分(conserved inflammatory component,CIC)的IBD网络,继而进行KDG(key driver gene)分析获得调控子,最后进行实验验证。具体步骤如下:
1、通过整合IBD风险SNP、表达数量性状基因座(eQTL)以及顺式调控元件来识别IBD基因。随后可以在第6步使用这些IBD基因进行KDG的排序。
2、使用RISK、CERTIFI以及MSH的表达谱数据进行加权基因共表达网络分析(WGCNA),从而获得共表达模块。
3、先前研究所描述的巨噬细胞富集的免疫网络(对IBD易感基因以及IBD相关炎症作用)作为基因种子集(seed immune network),以便在IBD组织特异性背景(即不同数据集不同疾病状态下的共表达模块)下识别同源基因集。具体来说,筛选出不同数据集中与免疫网络显著富集的共表达模块(P<0.05),称其为免疫超级模块(immune-super module,亦称tagged module)。
4、通过将每个数据集中的tagged模块进行合并,获得超级模块(super-module)。然后,将不同数据集的超级模块进行相交,得到核心免疫激活模块(core immune activation module,core IAM)。
5、利用三个数据集DNA以及RNA数据构建出各个数据集的贝叶斯网络后,将core IAM或MSS(macrophage-specific signatures)映射到贝叶斯网络获得CIC IBD网络或是MSG(macrophage specific genes)贝叶斯网络。注:巨噬细胞特异性特征(MSS,macrophage specific signatures)是来源于以下三种特征的并集。1)M1,M2和TPP (TNFα, PGE和TPP- (TLR2 ligand P3C))刺激的巨噬细胞共表达模块;2)结核感染的人类DC特征;3)100nM地塞米松治疗的人巨噬细胞特征。此外,使用巨噬细胞特异性基因(MSG,macrophage specific genes)集补充MSS。MSG是在人类巨噬细胞或小鼠小胶质细胞中观察到表达,但在星形胶质细胞、神经元和之前建立的任何M诱导多能干细胞系中均未表达的基因。
6、在CIC IBD网络(或MSG贝叶斯网络)中进行KDG的预测,并利用GWAS IBD基因、VEO(very early onset)IBD基因、免疫网络基因、MSH队列的基因表达特征(CD vs Control, CD vs UC)以及在CERTIFI队列中基因表达与临床特征相关的特征集来进行KDG排序。具体而言,排序可以分为两部分。一是对每个KDG基因映射到CIC IBD网络(或MSG网络),取两个路径长度的基因,获得这些基因与上述那些特征富集的P值,并以P值进行排序;二是对每个KDG基因映射到CIC IBD网络(或MSG网络),取两个路径长度的基因,获得这些基因与上述那些特征显著富集的次数,并以显著富集的次数进行排序。最终,结合两种排序获得综合排序。
7、对KDG基因进行实验验证,使用人类巨噬细胞并对相应KDG-knockdown进行巨噬细胞KDG的验证,以及借助小鼠炎症模型和KDG-knockdown进行CIC IBD的KDG验证。
结果中文:
1、对CIC IBD网络或IBD网络中巨噬细胞成分(MSG网络)关键驱动子的识别和排序
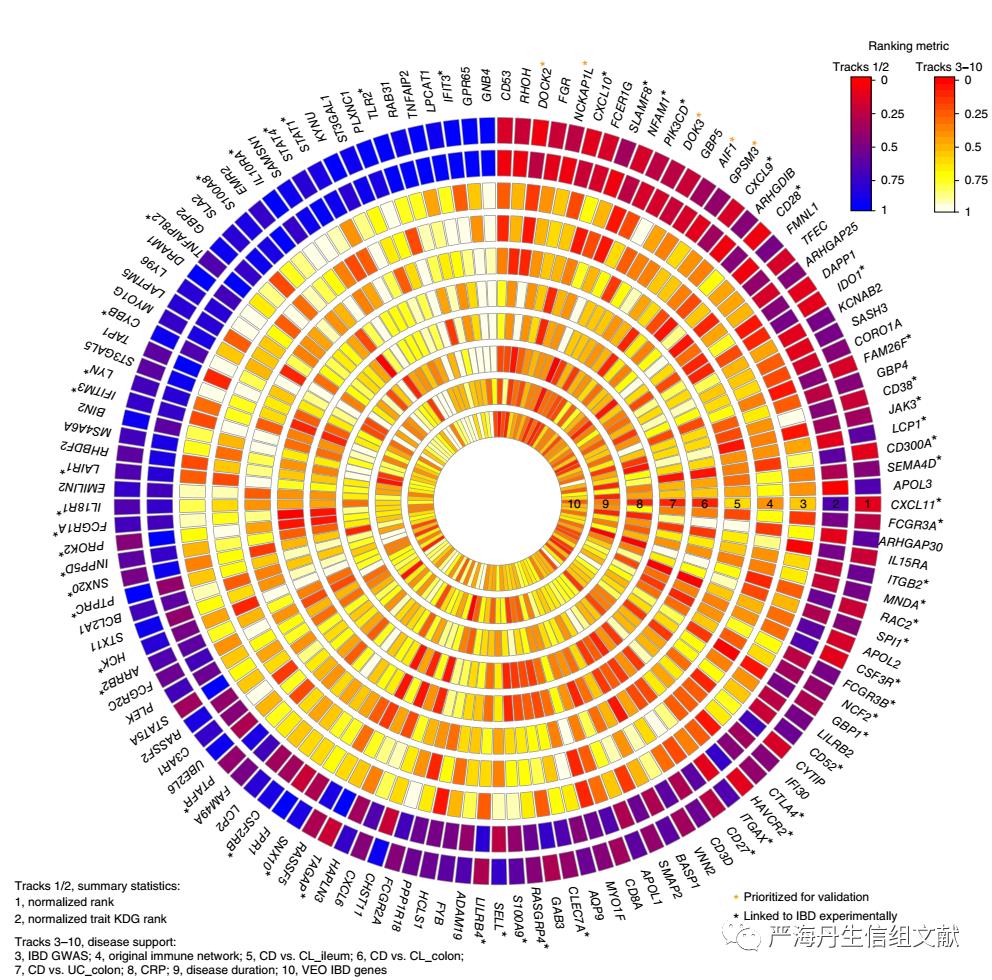
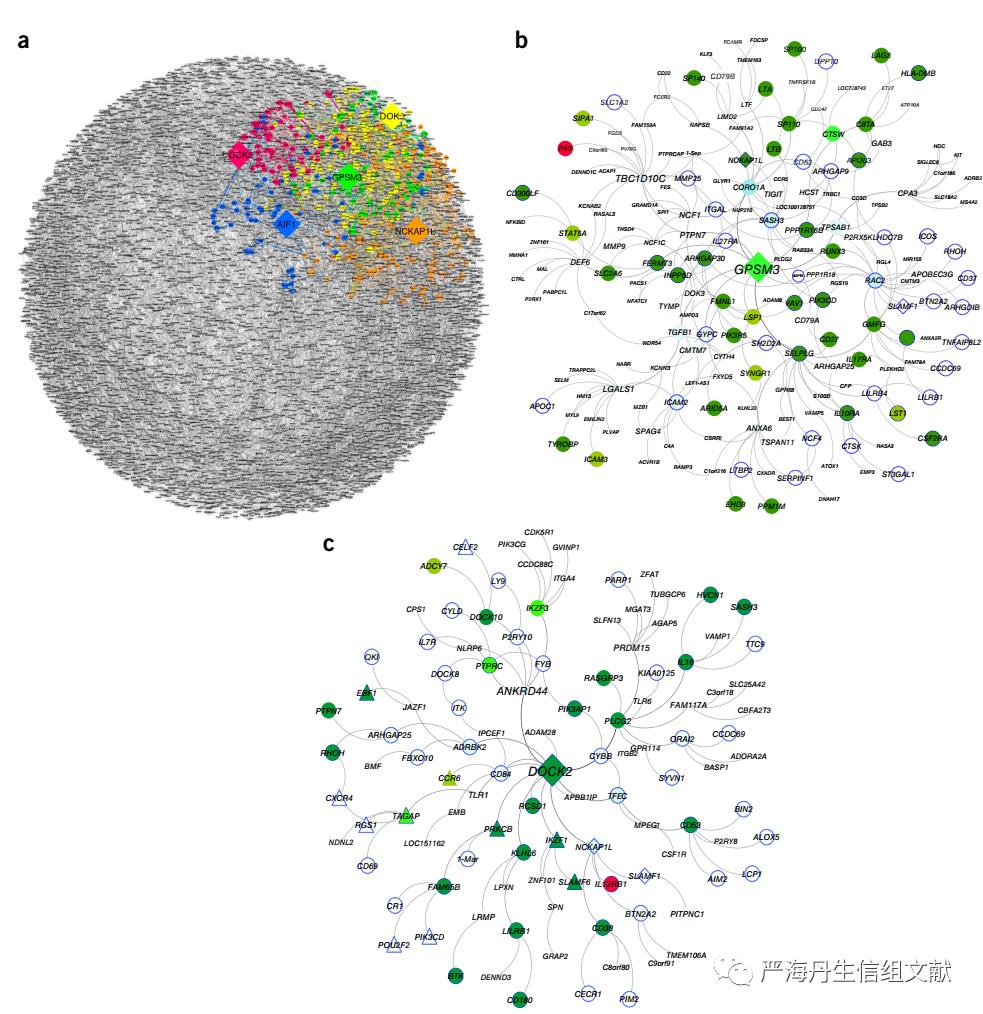
CIC IBD网络中关键驱动子的识别和排序。在将获得的core IMA(228个基因)映射到不同数据集的贝叶斯网络后,获得不同数据集的CIC IBD网络。为了阐明CIC IBD模型的调控框架及其对IBD发病机制,对每个数据集的CIC IBD网络都进行KDG识别,最终共获得133 KDG。在对133个KDG排序后,发现前10%的KDG中有5个KDG(DOCK2, GPSM3, NCKAP1L, DOK3)先前没有被证实与IBD相关。133个KDG排序具体如下图,不同圈表示在不同特征下KDG的排序。
IBD网络中巨噬细胞成分(MSG网络)关键驱动子的识别和排序。鉴于巨噬细胞在肠内稳态中起前哨作用并导致IBD中不适当的炎症反应、seed免疫网络中巨噬细胞富集以及核心IAM中巨噬细胞特异表达的富集,本文更加精确的确定了IBD网络的这一组成部分。
CERTIFI CIC IBD网络是巨噬细胞特征最富集的网络,因此将MSG中的基因投射到CERTIFI IBD网络上,并从这个投影中识别出最大的连接子网络(由这些基因的三个路径长度内的节点组成),获得IBD网络的巨噬细胞特异性成分。对网络进行KDG分析,发现59个KDG(皆在133个CIC IBD网络中识别的KDG),最终选择10个KDG(包括前面5个未被证实与IBD相关的4个基因)进行实验验证。
2、巨噬细胞KDG的体外分子网络验证
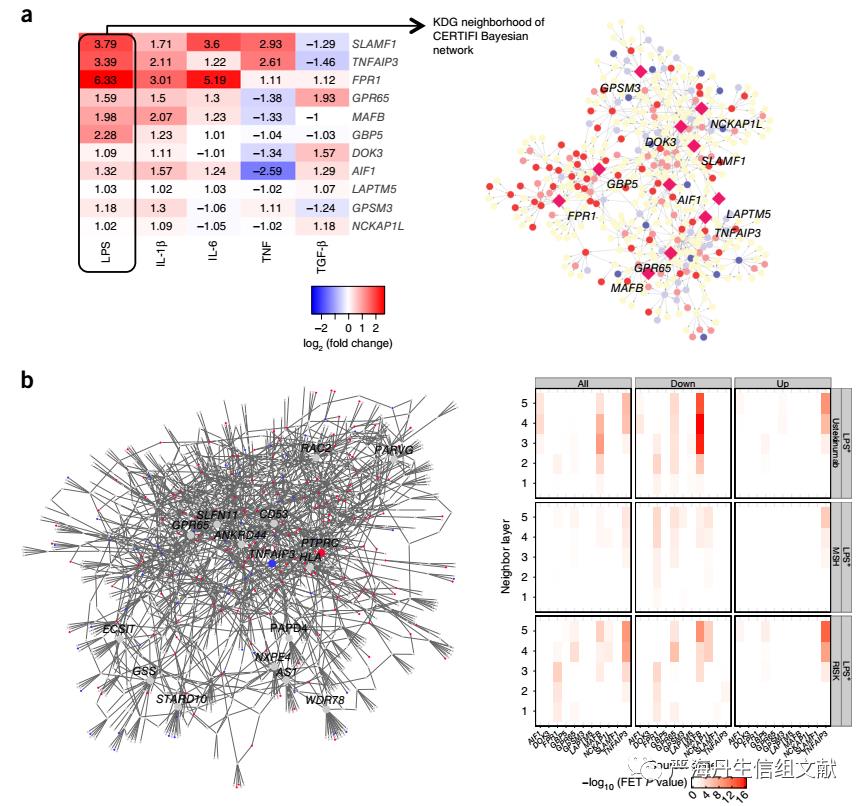
在对候选巨噬细胞KDG进行分子验证时,LPS( lipopolysaccharide,脂多糖)刺激诱导细胞炎症反应时产生最大的差异表达特征并且大多数KDG会对LPS刺激反应(下图a),因此在LPS刺激下,通过比较靶向11个KDG的siRNA与非靶向的siRNA进行KDG的分子验证。发现IBD网络中巨噬细胞特异性成分的相应KDG很好地预测了巨噬细胞特异性KDG-knockdown特征,即巨噬细胞KDG的子网与巨噬细胞特异性KDG-knockdown后表达改变的基因的显著富集(下图b)。
下图a左图表示不同刺激剂与对照组下KDG的倍数改变,a右图表示在LPS刺激下KDG及其邻居节点的倍数改变(菱形表示KDG,颜色表示上下调);下图b左图表示TNFAIP3-knockdown后CERTIFI IBD网络中节点改变的情况,b右图表示在LPS刺激性,相应KDG-knockdown后表达改变的基因与KDG子网富集的情况,纵轴表示取几层作为子网。
3、巨噬细胞KDG的体外分子网络验证
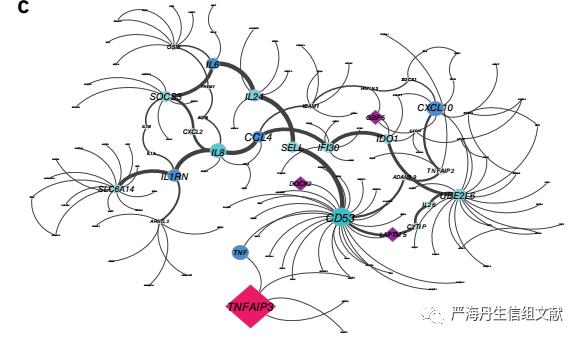
为了评估KDG在巨噬细胞中扰动的直接功能结果,本文测定了LPS刺激的巨噬细胞上清液中的细胞因子水平(KDG敲除与非靶向对照组相比)。其中GPSM3-knockdown时IL-1RA和CXCL10显著差异表达,NCKAP1L和FPR1-knockdown的IL-6、CCL4和CXCL10的显著差异表达,以及TNFAIP3-knockdown时导致最强的细胞因子差异表达。这些细胞因子(或其受体或配体)与IBD的遗传易感性有关,或被认为是IBD的药物靶点,包括TNF-α、IL-6、IL-1RA47、CXCL10和IL-12Rp40。下图表示TNFAIP3-knockdown后细胞因子的子网,其中红色节点表示TNFAIP3 KDG,紫色节点表示KDG,蓝色节点表示TNFAIP3-knockdown后显著差异表达的细胞因子。
4、肠道KDG的体内分子网络验证
为了了解CIC-IBD网络模型的KDGs是否会影响肠道炎症的易感性,在KDG-knockdown后使用DSS(dextran sulfate sodium)培养小鼠以获得小鼠结肠炎模型从而在体内对KDG进行验证。KDG-knockdown小鼠与野生型对照的差异基因显著富集到IBD相关的分子途径,并且利用表达谱构建的共表达模块也显示出对GWAS IBD基因、VEO IBD基因以及核心IAM的显著富集,表明物种间CIC IBD网络的保守性。此外,本文还进一步测试了给定的KDG的knockdown特征(即KDG-knockdown后表达显著改变的基因)是否会与网络预测的受该KDG控制的一组基因(即KDG特征)显著重叠。除了DOK3外,其他KDG的实验扰动特征会显著地富集IBD网络预测的KDG特征(如下图)。
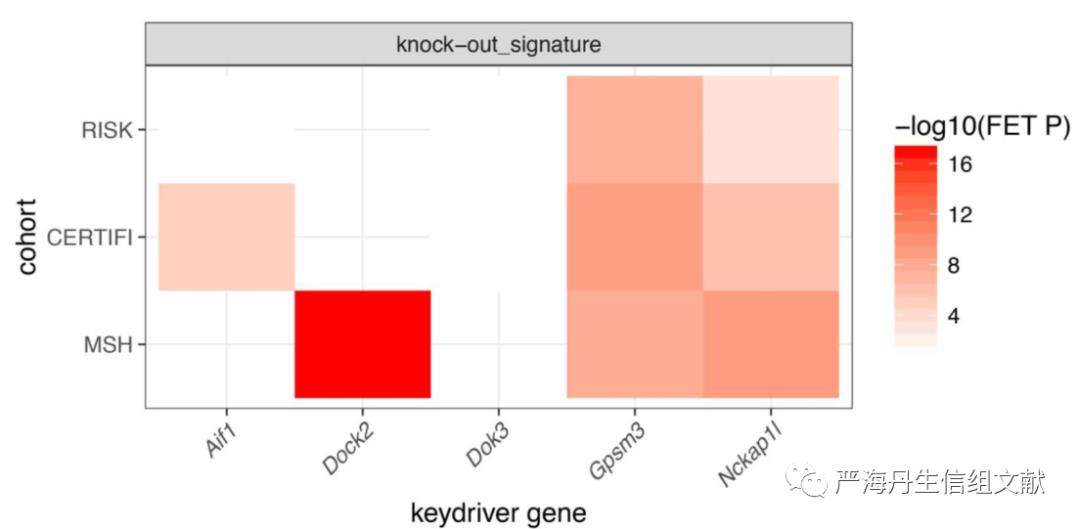
对于每个IBD网络来说,KDG都可以通过KDG特征(即KDG所控制的基因)链接,如下图a中的CERTIFI IBD网络所示。在CERTIFI队列中,与KDG基因表达特征重叠的KDG子网中的基因与那些CRP(C-reactive protein)、乳铁蛋白和钙卫蛋白等临床信息相关的IBD易感基因也显著富集(如下图b,c)。
下图a表示IBD网络中5个KDG的预测转录特征;b图表示GPSM3的子网,其中浅绿色节点表示巨噬细胞IBD CRESNP基因,森林绿色表示DSS培养下GPSM3-knockdown的特征,亮绿色表示这两者兼之,蓝色边框节点表示CRP(C-reactive protein)、乳铁蛋白和钙卫蛋白等临床信息相关的基因,红色节点表示ustekinumab的分子靶标;c图表示DOCK2的子网,其中浅绿色节点表示T细胞IBD CRESNP基因,森林绿色表示DOCK2-knockdown的上调特征,亮绿色表示这两者兼之,蓝色边框节点表示CRP(C-reactive protein)、乳铁蛋白和钙卫蛋白等临床信息相关的基因,红色节点表示与ustekinumab相关。
5、肠道KDG的体内验证
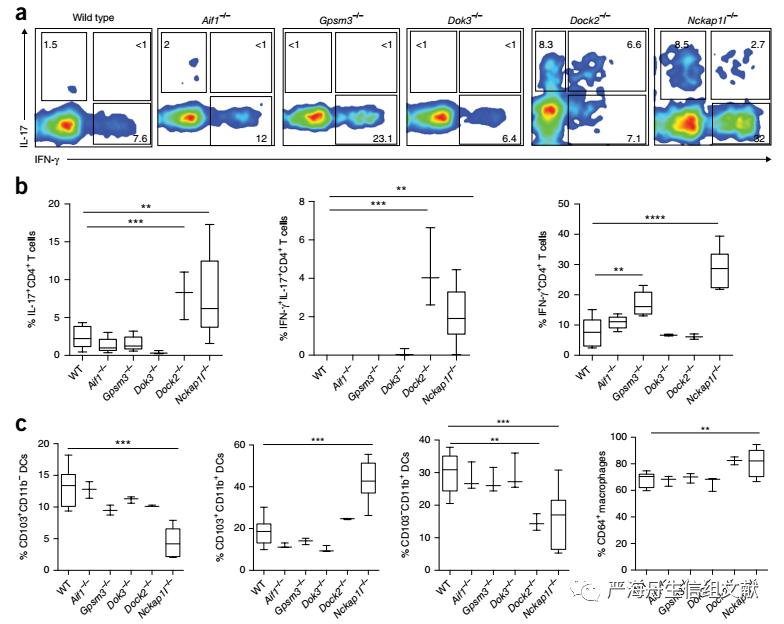
为了验证肠道KDGs与IBD的相关性,我们首先研究了扰动这些基因是否会破坏免疫稳态。对于T细胞,本文评估了CD4+T细胞中IFN-γ和IL-17A的产生(两者都与克罗恩病的病理学有关)。与野生型同窝对照组相比,Nckap1l−/−小鼠、Dock2−/−小鼠和Gpsm3−/−小鼠肠道固有层中IL-17A+和/或IFN-γ+CD4+T细胞的频率存在显著差异(下图a, b)。对于髓系细胞,使用抗CD103、CD11b和CD64的抗体定义了肠道树突状细胞(DC)和巨噬细胞的功能亚群。Nckap1l−/−小鼠的CD103+CD11b+细胞频率升高,而Nckap1l−/−和Dock2−/−小鼠的CD11b+单阳性DC频率降低,同时Nckap1l−/−小鼠的CD103+DC频率降低,CD64+巨噬细胞频率升高,Dok3−/−,Gpsm3−/−,和Aif1−/−小鼠在结肠中的这些髓细胞亚群的免疫细胞比率没有显著差异(下图c)。
为了确定KDGs是否影响肠道炎症的易感性,本文采用了DSS、TNBS等小鼠结肠炎模型。野生型同窝对照小鼠在DSS、TNBS培养后出现肠道炎症症状。与同窝鼠对照组相比,Nckap1l−/−和Gpsm3−/−小鼠在DSS治疗后有更严重的体重减轻和更高的内镜评分(下图a, b)。在DSS治疗下,Aif1−/−和Dok3−/−缓解小鼠的体重减轻(下图a)。与野生型同窝对照相比,DSS治疗下Dock2-/-,Gpsm3-/-,Dok3-/-和Nckap1-/-小鼠均表现出显著更差的内窥镜评分(下图c,d)。 同时与野生型对照相比,Dok3-/-和Gpsm3-/-小鼠表现出显著更差的组织学评分(下图e),而Aif1-/-小鼠表现出显着降低的病理学评分(下图f-k)。
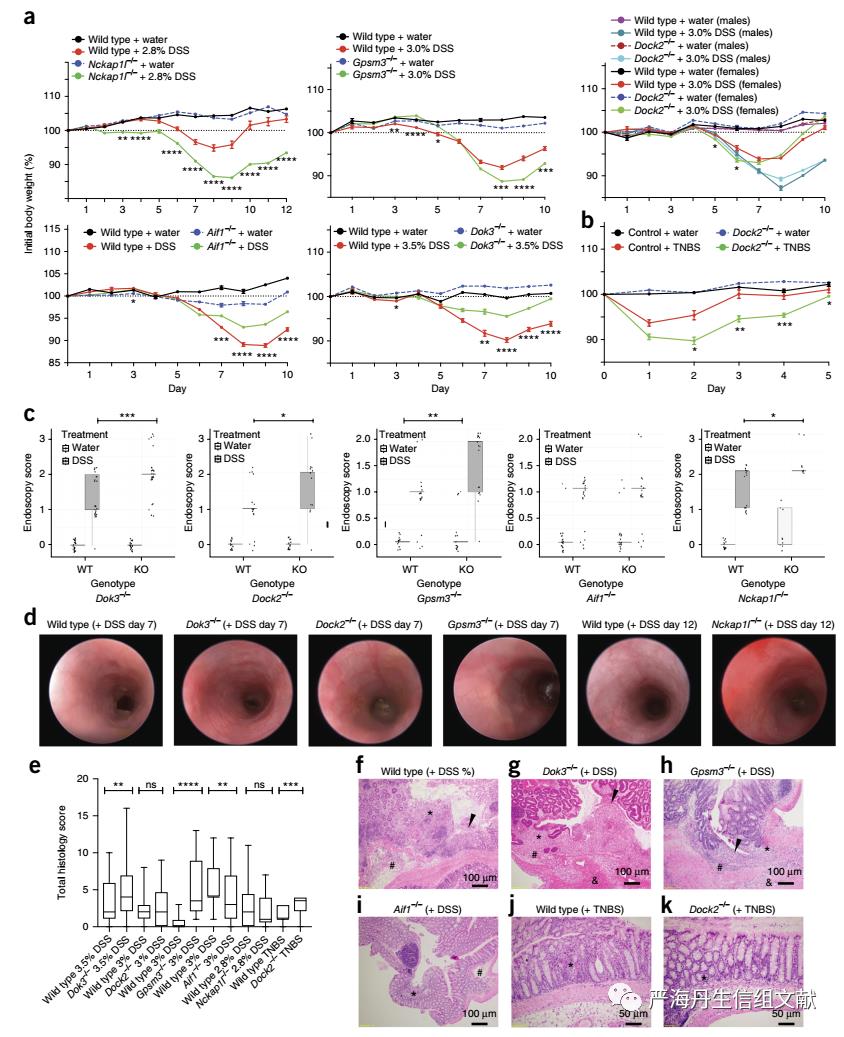
总体来说,本文检测的每只KDG-knockdown小鼠在结肠炎中至少表现出显著的体重减轻表型和肠道炎症表型在内的一种表型(如下表)。
讨论中文:
有人支持KDG在疾病中的机械作用是由网络的调节状态改变所驱动的,而这调节状态的改变受到免疫有关过程的明确影响。本文确定的KDG中存在一个统一主题,即RAC激活和细胞骨架重排,而这是免疫过程中的一个中心介质,与克罗恩病、实验性结肠炎以及溃疡性结肠炎有关(如下图NF-κB途径,RAC及其肌动蛋白细胞骨架重排,RAS,NLRP3炎性小体途径以及TLR和趋化因子受体均由本文确定的KDG调节)。本文通过构建预测网络模型识别KDG以及使用生物实验验证了KDG的合理敏感性,但是对于相应的特异性理解是一项十分困难的任务。
以上是关于功能基因组学的预测网络模型识别炎症性肠病的调节因子的主要内容,如果未能解决你的问题,请参考以下文章
DL笔记|使用卷积神经网络构建转录因子结合位点预测模型(deepbind)
机器学习肝炎预测模型machine learning for hepatitis prediction model
易基因:全基因组ChIP-seq分析揭示细菌转录因子PhoB的基因内结合位点|mBio
R语言glm拟合logistic回归模型实战:基于glm构建逻辑回归模型及模型系数统计显著性分析每个预测因子对响应变量的贡献