E2B(R3)XML文件递交系统上线;国家药监局调整《医疗器械分类目录》部分内容
Posted 德信远
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了E2B(R3)XML文件递交系统上线;国家药监局调整《医疗器械分类目录》部分内容相关的知识,希望对你有一定的参考价值。
本期看点
一、药品评价中心(不良反应监测中心)新闻
1、关于E2B(R3)XML文件递交系统上线的通知
二、药品监督管理局新闻
1、调整《医疗器械分类目录》部分内容
2、国家医疗器械监督抽检结果的通告
3、中药保护品种的公告
药品评价中心(不良反应监测中心)新闻
关于E2B(R3)XML文件递交系统上线的通知
发布日期:2020-12-31
各有关单位:
为落实《关于适用国际人用药品注册技术协调会二级指导原则的公告》(2018年10号公告)中E2B(R3)指导原则的转化实施工作要求,我中心于2019年11月22日发布了《个例安全性报告E2B(R3)区域实施指南》并于2020年1月1日上线了E2B(R3)电子数据传输系统。
根据工作安排,我中心在E2B(R3)电子数据传输系统基础上另行开发建设了E2B(R3)XML文件递交系统,现计划于2021年1月1日更新上线,具体递交说明详见附件。
附件:E2B(R3)XML文件递交系统有关说明


国家药品监督管理局新闻
调整《医疗器械分类目录》部分内容
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2020年 第147号) 发布时间:2020-12-31
为进一步深化医疗器械审评审批制度改革,依据医疗器械产业发展和监管工作实际,按照《医疗器械监督管理条例》有关要求,国家药监局决定对《医疗器械分类目录》部分内容进行调整。现将有关事项公告如下:
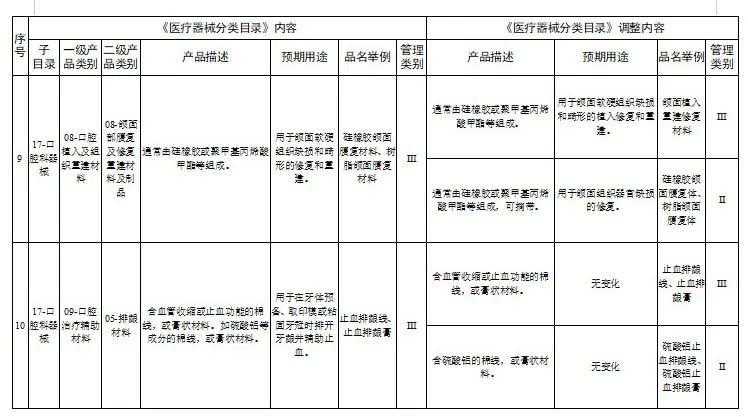
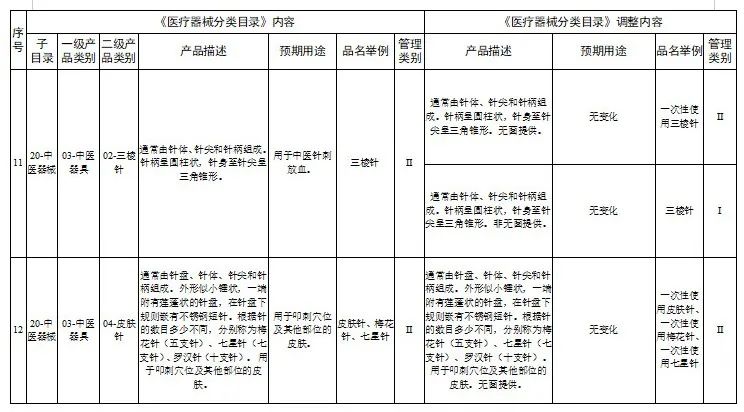
一、调整内容
对28类医疗器械的《医疗器械分类目录》内容进行调整,其中,15类医疗器械管理类别进行调整(见附件1),13类医疗器械目录内容进行调整(见附件2)。
二、实施要求
(一)自本公告发布之日起,药品监督管理部门依据《医疗器械注册管理办法》《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》《关于第一类医疗器械备案有关事项的公告》等,按照调整后的类别受理医疗器械注册和备案申请。
(二)对于已受理尚未完成注册审批(包括首次注册和延续注册)的医疗器械,药品监督管理部门继续按照原受理类别审评审批,准予注册的,核发医疗器械注册证,并在注册证备注栏注明调整后的产品管理类别。
(三)对于已注册的医疗器械,其管理类别由第三类调整为第二类的,医疗器械注册证在有效期内继续有效。如需延续的,注册人应当在医疗器械注册证有效期届满6个月前,按照改变后的类别向相应药品监督管理部门申请延续注册,准予延续注册的,按照调整后的产品管理类别核发医疗器械注册证。
对于已注册的医疗器械,其管理类别由第二类调整为第一类的,医疗器械注册证在有效期内继续有效。注册证到期前,注册人可向相应药品监督管理部门申请产品备案,备案资料符合要求的,药品监督管理部门应当按照相关要求制作备案凭证,并在其网站公布备案信息表中登载的信息。
(四)医疗器械注册证有效期内发生注册变更的,注册人应当向原注册部门申请注册变更。如原注册证为按照原《医疗器械分类目录》核发,本公告涉及产品的注册变更文件备注栏中应当注明公告实施后的产品管理类别。
(五)各级药品监督管理部门要加强《医疗器械分类目录》内容调整的宣贯培训,切实做好相关产品审评审批、备案和上市后监管工作。
本公告自发布之日起实施。
附件:1.医疗器械分类目录产品管理类别调整意见汇总表
2.医疗器械分类目录内容调整意见汇总表
国家药监局
2020年12月18日
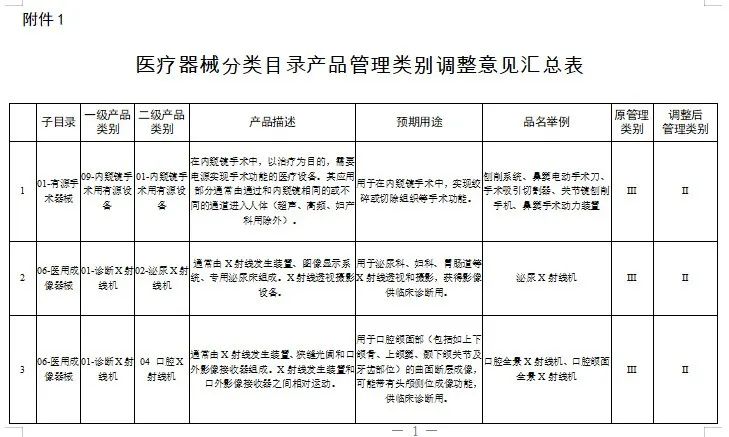
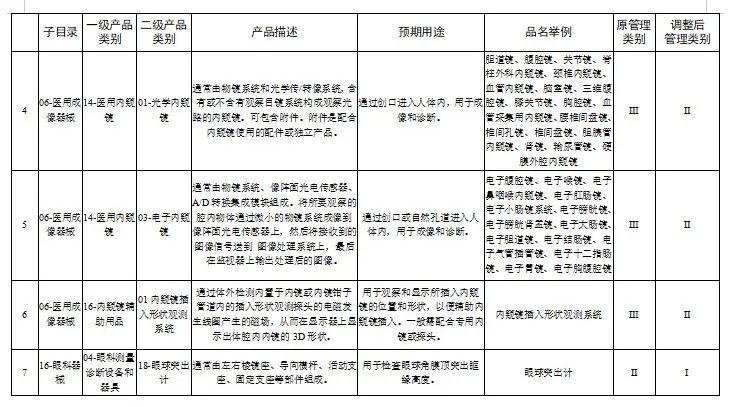
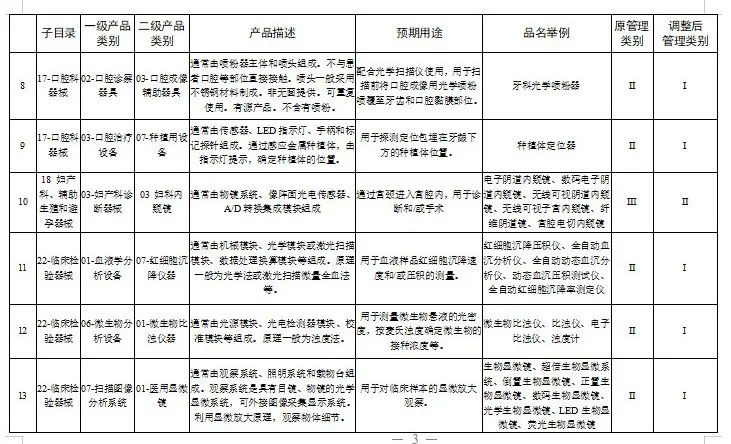
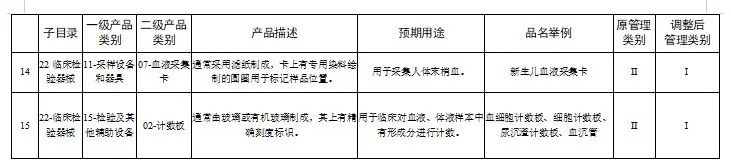
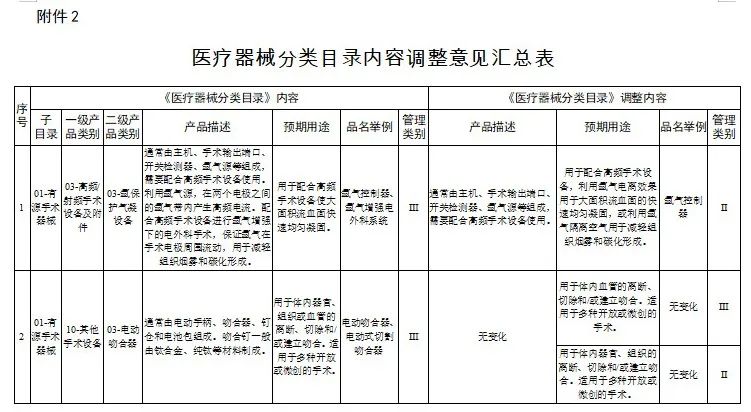
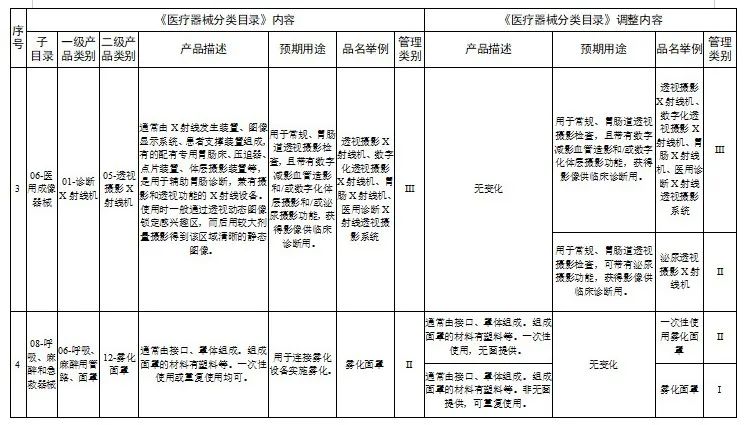
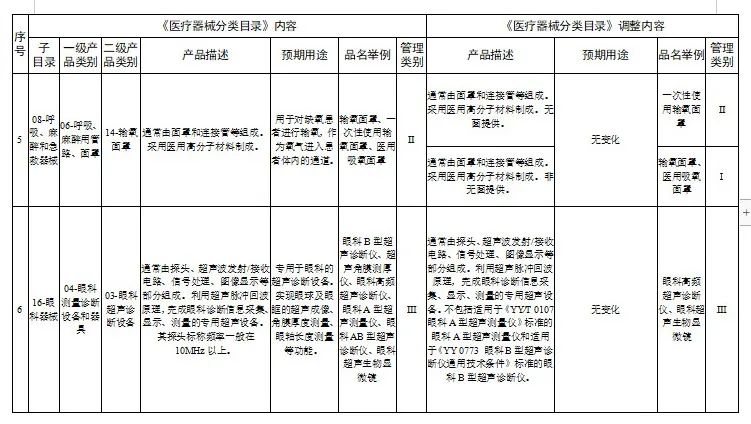
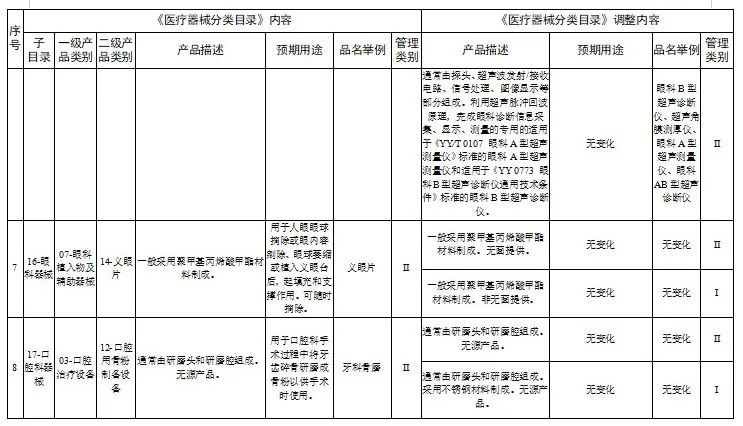
国家医疗器械监督抽检结果的通告
国家药监局关于发布国家医疗器械监督抽检结果的通告(第5号)(2020年 第91号) 发布时间:2020-12-31
为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对定制式固定义齿、医用氧气浓缩器(医用制氧机)、特定电磁波治疗器等11个品种进行了产品质量监督抽检,共52批(台)产品不符合标准规定。具体情况通告如下:
一、 被抽检项目不符合标准规定的医疗器械产品
(一)定制式固定义齿6批次:分别为佛山市南海雅皓义齿有限公司、衡阳市蒸湘爱高义齿制作中心、济南锦冠桥义齿有限公司、南充川口义齿制作有限公司、珠海市华冠贸易有限公司、珠海市三通陶齿有限公司生产,涉及孔隙度不符合标准规定。
(二)腹部穿刺器3批次:分别为杭州桐庐医疗光学仪器有限公司、浙江格宜医疗器械有限公司生产,涉及硬度(如适用)、配合性能不符合标准规定。
(三)高频手术设备1台:山东玉华电气有限公司生产,样品在检验过程中不能正常使用,不符合标准规定。
(四)髋臼内衬1批次:SAMO S.p.A生产,涉及关节面的尺寸和公差不符合标准规定。
(五)裂隙灯显微镜3台:分别为苏州六六视觉科技股份有限公司、興和株式会社、意大利C.S.O.SRL生产,涉及设备或设备部件的外部标记不符合标准规定。
(六)射频消融导管1台:St.Jude Medical圣犹达医疗用品有限公司生产,涉及直流电阻不符合标准规定。
(七)输液泵(注射泵、镇痛泵、胰岛素泵)2台:浙江迈帝康医疗器械有限公司生产,涉及可听报警信号、工作数据的准确性不符合标准规定。
(八)睡眠呼吸暂停治疗设备11台:分别为DeVilbiss Healthcare LLC、Respironics,Inc.伟康股份有限公司、Somnetics International Inc.、费雪派克医疗保健有限公司、广州南北电子科技有限公司、杭州宜眠医疗科技有限公司、吉林省沃鸿医疗器械制造有限公司、南京舒普思达医疗设备有限公司、沈阳新松医疗科技股份有限公司、株式会社メトラン生产,涉及设备或设备部件的外部标记、使用说明书、技术说明书、最大压力限制、工作数据准确性不符合标准规定。
(九)特定电磁波治疗器5台:分别为安徽乐金健康科技股份有限公司、成都鑫博浩科技有限公司、河南省南阳国防科技工业电气研究所、营口维康医疗器械有限公司生产,涉及设备或设备部件的外部标记、指示灯和按钮、随机文件、与供电网的分断、控制器和仪表的标记、电源软电线、指示器、控制器的操作部件、防护件不符合标准规定。
(十)一次性使用便携式输注泵 非电驱动1批:Leventon S.A.U生产,涉及准确度(流量)不符合标准规定。
(十一)医用氧气浓缩器(医用制氧机)18台:分别为Respironics,Inc.、Respironics,Inc.伟康股份有限公司、北京康祝医疗器械有限公司、常州中进医疗器材股份有限公司、福州瑞康医疗器械有限公司、吉林爱尔康医疗器械有限公司、江苏富林医疗设备有限公司、欧姆龙(大连)有限公司、上海冠瑞医用电子有限公司、深圳心诺智造医疗有限公司、沈阳爱尔泰科技有限公司、沈阳新松医疗科技股份有限公司生产,涉及振动与噪声、氧浓度、输入功率、控制器和仪表的标记、外部标记、外壳的封闭性、不用工具就可打开的罩和门的安全性、连续漏电流和患者辅助电流(正常工作温度下)不符合标准规定。
以上抽检不符合标准规定产品具体情况见附件。
二、对抽检中发现的上述不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。省级药品监督管理部门要督促企业对抽检不符合标准规定的产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。
特此通告。
附件:抽检不符合标准规定产品名单
国家药监局
2020年12月29日
国家药品监督管理局2020年第91号通告附件.doc
https://www.nmpa.gov.cn/directory/web/nmpa/images/1609395735302062303.doc
中药保护品种的公告
国家药监局关于中药保护品种的公告(延长保护期第6号)(2020年 第146号) 发布时间:2020-12-31
根据《中药品种保护条例》第十六条及有关规定,经国家中药品种保护审评委员会组织的委员审评,国家药品监督管理局核准:
对浙江九旭药业有限公司生产的银杏酮酯滴丸中药保护品种继续给予2级保护,其保护期限、保护品种编号分别为2020年12月28日—2027年05月09日、ZYB20720200100。
特此公告。
国家药监局
2020年12月28日
以上是关于E2B(R3)XML文件递交系统上线;国家药监局调整《医疗器械分类目录》部分内容的主要内容,如果未能解决你的问题,请参考以下文章