Bisecting GlcNAc is a general suppressor of terminal modification of N-glycan (解读人:王茹凯)
Posted ilifeiscience
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了Bisecting GlcNAc is a general suppressor of terminal modification of N-glycan (解读人:王茹凯)相关的知识,希望对你有一定的参考价值。
文献名:Bisecting GlcNAc is a general suppressor of terminal modification of N-glycan(平分GlcNAc是N-聚糖末端修饰的一般抑制剂)
期刊名:MCP
发表时间:(2019年10月)
单位:
- 广岛大学物质科学研究科
- 爱尔兰国立大学糖业科学小组
- RIKEN-Max Planck联合研究中心结构糖生物学小组
物种:小鼠大脑组织、肾组织
技术:转染、蛋白印迹、凝集素印迹、免疫荧光、定量PCR、糖基转移酶化验、LC-MSMS、建模
一、 概述:
在这里,我们发现,等分GlcNac(n -聚糖中的一个分支糖残基)抑制各种类型的终端表位的生物合成Ñ -glycans,包括岩藻糖,唾液酸和人天然杀伤-1。在缺乏平分GlcNAc的生物合成酶GnT-III的小鼠中,这些表位在N-聚糖中的表达升高,并且相反地在细胞中被GnT-III过表达抑制。N-聚糖末端的许多糖基转移酶显示更喜欢非等分的N-聚糖作为其一分为二的对应物的底物,而未发现其mRNA、酶的上调。这表明在GnT-III缺陷型小鼠中末端N-聚糖表位的表达升高归因于生物合成酶的底物特异性。分子动力学模拟进一步证实,未等分的聚糖优先被那些糖基转移酶所接受。这些发现揭示了蛋白质N-糖基化的新调节机制。
二、 研究背景:
糖蛋白装饰有复杂的聚糖,以发挥蛋白功能。但是,复杂的聚糖生物合成的调节机制尚不清楚。本文旨在研究复杂的聚糖生物合成的调节机制。
三、实验设计:
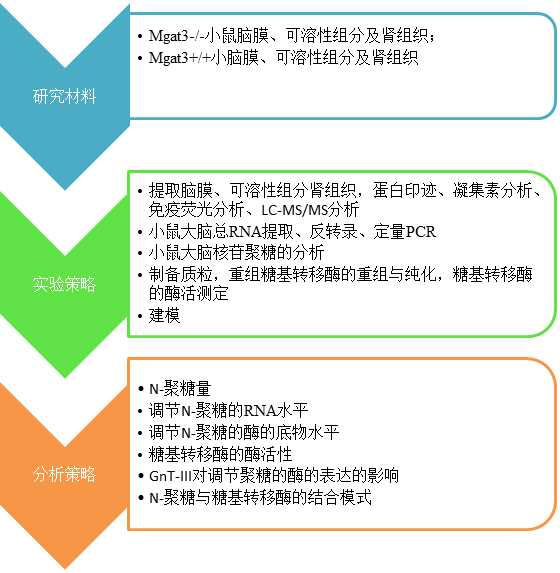
四、研究成果:
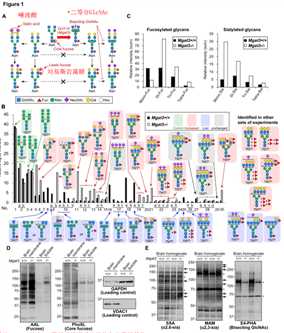
为了确定平分GlcNAc是否影响N-聚糖其他部分的生物合成,通过液相色谱(LC)-质谱(MS)/ MS分析了Mgat3 + / +和Mgat3-/-小鼠大脑的N-聚糖结构(图1B)。我们首先发现,在Mgat3-/-脑中,具有二等分GlcNAc并被推论为二等分GlcNAc的N-聚糖消失了(图1B,蓝色表示)。Mgat3-/-脑中许多聚糖的水平增加(图1B,用红色表示),并且令人惊讶的是,这些增加的聚糖中的岩藻糖和唾液酸残基的数量高于Mgat3-/-脑中已减少的N -聚糖。在此,Mgat3-/-中多岩藻糖基化聚糖的信号强度总和要比Mgat3 + / +高得多,而Mgat3-/-脑中单岩藻糖基化聚糖的信号强度却降低到不足50%(图1C,左)。清楚地观察到Mgat3-/-中单唾液酸化和多唾液酸化聚糖的相似增加(图1C,右)。与MS结果一致,凝集素印迹表明,Mgat3-/-大脑蛋白被AAL(与岩藻糖反应)(图1D)染色更强。 Mgat3 + / +和Mgat3-/-脑之间的岩藻糖特异性PhoSL染色不变(图1D,2面板)表明,Mgat3-/-脑中Le型岩藻糖基化增强,但核心岩藻糖基化未增强。我们还观察到,在用SSA、 MAM(能富集唾液酸的糖肽)的凝集素印迹中,Mgat3-/-brain在Mgat3-/-brain中的a2,6-唾液酸化和a2,3唾液酸化分别增加(图1E,左、中间面板)。平分的GlcNAc反应性凝集素,促红细胞凝集的植物血凝素(E4-PHA)信号消失说明Mgat3-/-脑中不存在平分的GlcNAc(图1E,右图)。
总的来说,MS和凝集素印迹数据表明,Mgat3-/-的末端岩藻糖基化和唾液酸化增加,这表明平分GlcNAc对N-聚糖中这些末端结构的生物合成具有负面影响。
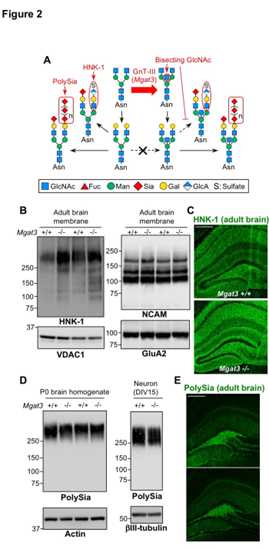
接下来,我们检查了N-聚糖的其他末端修饰的水平,这些水平无法通过常规MS分析检测到,例如HNK-1和聚唾液酸(polySia)(图2A)。对成年小鼠脑进行Western印迹和免疫染色显示,Mgat3-/-脑中HNK-1表位的水平增加了(图2B,C)。对新生儿(P0)小鼠大脑和原代脑神经元(从E18胚胎分离的DIV15)进行的蛋白质印迹显示,Mgat3 + / +和Mgat3-/-小鼠之间的polySia表达水平几乎相同(图2D )。对成年脑切片进行免疫染色也证实了成年Mgat3 + / +和Mgat3-/-小鼠之间polySia的等效表达(图2E)。
这些数据显示,Mgat3-/-脑中的HNK-1表位上调而不是polySia
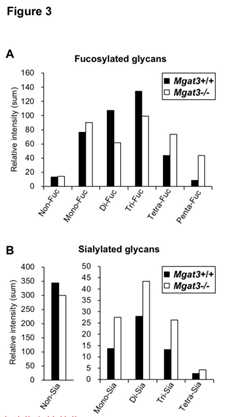
为了检查在大脑中发现的上述结果是一般的还是更具大脑特异性的,我们还通过LC-MS分析了肾脏中的N-聚糖。在肾脏中观察到的聚糖结构的数量高于在大脑中的聚糖结构。MS分析中岩藻糖基化聚糖信号强度的总和表明,Mgat3-/-中的四岩藻糖基化多糖和五岩藻糖基化的N-聚糖的数量比Mgat3 + / +中的高,而在岩藻糖基化中,二岩藻糖基化聚糖的信号强度降低在 Mgat3-/-肾脏(图3A)。
同样,Mgat3-/-肾脏中未唾液酸化的聚糖减少,而唾液酸化的聚糖增加(图3B)。
这些发现与大脑和大脑的结果一致:提示二等分GlcNAc的缺失通常会导致聚糖末端修饰的增加
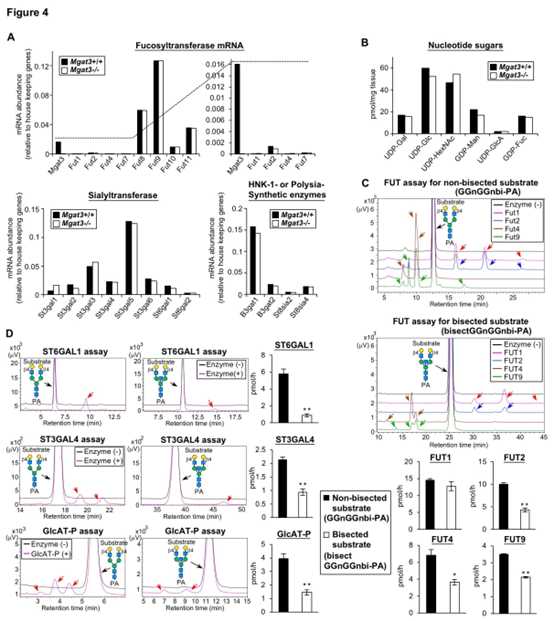
岩藻糖基转移酶(Fut1-11),唾液酸基转移酶(St3gal1-6,St6gal1,2),HNK-1合成酶(B3gat1,2)和polySia合成酶(St8sia2,4)在Mgat3-/-脑中均未上调(图 4A)。Mgat3-/-小鼠中所有测试的供体底物水平均未上调(图4B)。根据产物的峰面积测量其酶活性,发现除FUT1外,所有测试的酶对平分型底物的活性均低于对非平分型底物的活性(图4C,D)。
这有力地表明,二等分GlcNAc的丧失将N-聚糖从非优选的酶底物转化为用于N-聚糖末端修饰的酶,从而导致了Mgat3-/-大脑中岩藻糖,唾液酸和HNK-1表位的更高表达水平。
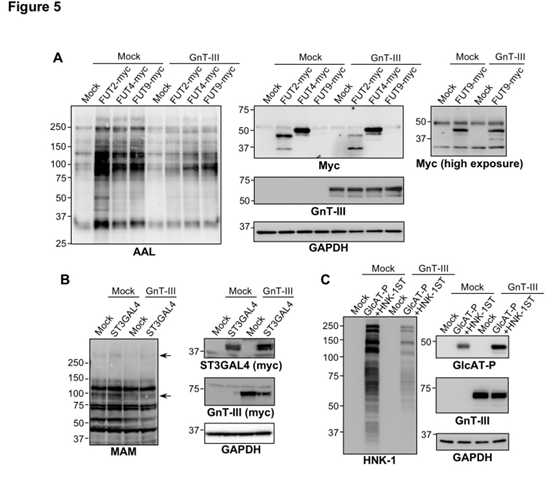
细胞内的Le -岩藻糖基化酶、ST3GAL4(唾液酸转移酶)和GIcAT-P(葡糖醛酸基转移酶)活性被GnT-III过表达抑制。Hela细胞中Le型岩藻糖基化酶FUT2,FUT4和FUT9的过表达导致AAL(与L-岩藻糖特异性结合的凝集素)反应性急剧增加(图5A),FUT过表达对AAL反应性的这种作用已通过GnT-III的共表达得到了明显抑制(图5A)。CHO细胞中ST3GAL4的过表达略微增加了细胞蛋白的MAM(与唾液酸特异性结合的凝集素)反应性,而GnT-III的过表达降低了这种作用(图5B)。GnT-III过表达明显抑制了Hela细胞中HNK-1的产生(图5C)
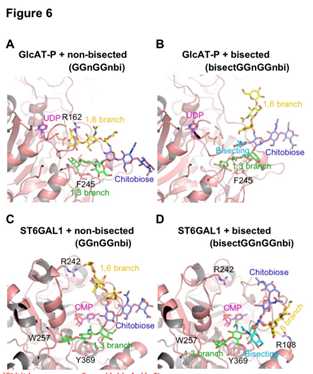
非二等分和二等分n-聚糖与GlcAT-P和ST6GAL1的结合构象。分子建模研究发现:GlcAT-P复合物与非等分双天线N-聚糖(GGnGGnbi)显示a1,3-分支与GlcAT-P受体结合位点结合,而a1,6-分支的Gal-6‘与R162形成了良好的静电相互作用,GlcAT-P转移了葡萄糖醛酸 到a1,3-分支的效率要比到a1,6-分支的效率高相比之下(图6A)。a1,6-分支对等双天线N-聚糖(bisectGGnGGnbi)在GlcAT-P复合物中的表达占据了延伸的构象,并且与GlcAT-P的相互作用消失了(图6B)。
a1,3-分支的末端Gal-6部分结合到受体位点并与W257形成堆积相互作用(图6C)。在平分GlcNAc的情况下,a1,6-分支具有反向折叠构象(补充图S8F),并且主要与壳二糖核心相互作用。Gal-6’和酶之间这种极性相互作用的丧失导致底物的识别能力差(图6D)。这些发现表明,被二等分的聚糖被GlcAT-P弱识别。
五、文章亮点:
- N-聚糖中二等分GlcNAc的丢失会增加各种末端聚糖修饰。
- 糖基转移酶通常在平分GlcNAc时对聚糖的作用不佳。
- 二等分的GlcNAc的存在会改变N-聚糖的整体构象。
- 平分GlcNAc用作末端修饰的一般抑制子。
阅读人:王茹凯
以上是关于Bisecting GlcNAc is a general suppressor of terminal modification of N-glycan (解读人:王茹凯)的主要内容,如果未能解决你的问题,请参考以下文章
第三节4:类K-Means算法之二分K-均值算法(bisecting K-Means算法)
Spark2.0机器学习系列之8: 聚类分析(K-Means,Bisecting K-Means,LDA,高斯混合模型)
HP Gen9 做万兆网卡直通时报错:Device is ineligible for IOMMU domain attach due to platform RMRR requirement. C
Androidproject中增加图片,报错cannot be resolved or is not a field
openGL之API学习(二零零)GL_TEXTURE_GEN_S GL_TEXTURE_GEN_T GL_TEXTURE_GEN_R GL_TEXTURE_GEN_Q