如何使用美国FDA数据库查询原研药品信息及其应用
Posted 北京药研汇
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了如何使用美国FDA数据库查询原研药品信息及其应用相关的知识,希望对你有一定的参考价值。
一、美国FDA药品数据库的建库目的及主要用途是什么?
美国FDA药品数据库能够让你查询关于FDA批准的新药、仿制药和治疗性生物制品的官方信息。
美国FDA药品数据库的主要用途:
1、寻找药品批准的标签/说明书
2、寻找一个创新药的仿制药品
3、寻找新药和仿制药的治疗等效产品
4、寻找1998年以后批准药品的消费信息
5、找到一个特定的活性成分对应的所有药品
6、查看药品的审批历史记录
二、美国FDA药品数据库包含哪些药品
美国FDA药品数据库包含目前在美国批准上市的处方药(RX)、非处方药(OTC)和治疗性生物制品。美国FDA药品数据库还包括撤市药品和化学类型6类(New indication [no longer used])。
美国FDA药品数据库包含了大多数1939年以来批准的药品。对于1998年之后批准的药品,大多数的标签、批准书、历史回顾和其它信息都是可用的。
注意:美国FDA药品数据库并非包含所有的治疗性生物制品。
主要包括以下类型:
a、单克隆抗体;
b、细胞因子、生长因子、酶、免疫调节剂和溶栓。
c、从动物或微生物中提取的用于治疗目的蛋白质,包括这些产品的重组版本(除凝血因子)
d、其他非疫苗的治疗性免疫疗法。
三 、图文解读:手把手教你如何使用Drugs@FDA(FDA数据库) 原研药品查询
FDA的网站包罗万象,Drugs@FDA作为其中一个数据库主要可以帮助我们完成以下两项工作:
1)了解药物审批历史和标签信息
2)寻找新药或仿制药的治疗等效产品(仿制药)
工欲善其事,必先利其器。作为药学工作者,快速有效查询到相关的药品信成为一项必备技能,今天就利用Drugs@FDA这把利器,带大家熟悉美国上市药品信息的查询。
我们以查找抗癌药物Sorafenib (Nexavar)的药品说明书和审评历史为例。
1、首先,在Drugs@FDA的搜索栏输入活性成分名称“Sorafenib”或者商品名“Nexavar”,然后提交。
http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm#apphist
2、进入“DrugDetails”,我们就可以看到这个药的具体信息
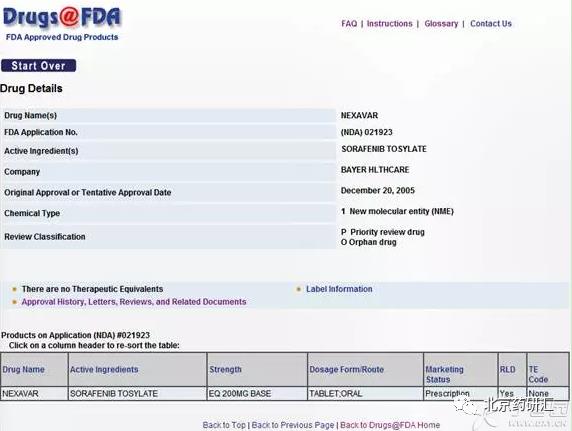
可以看到,药物的信息主要包括:商品名,FDA申请号,药物活性成分,研发公司,批准时间,药物化学类别和审评类别。在下方我们还能看到该药的规格、剂型、给药途径、市场信息以及是否为RLD(Reference Listed Drug)和TE(TherapeuticEquivalent)Code。
注:与国内不同,FDA的化学类型主要包括以下类型:
1类:新类分子化合物(NME);
2类:新活性成分(已上市活性成分的盐、非共价键衍生物和酯);
3类:新剂型;
4类:新药物组合;
5类:新复方或新生产者;
6类:新适应症;
7类:上市但未经NDA批准的药品;
8类:变为非处方药;
9类:新适应症,通过不同NDA申请,与原NDA合并;
10:新适应症,通过不同NDA申请,不与原NDA合并。
审评分类:
P:优先审评的药物;
S:标准审评的药物;
O:孤儿药
3、我们继续点击Label information或者ApprovalHistory进入相应页面。
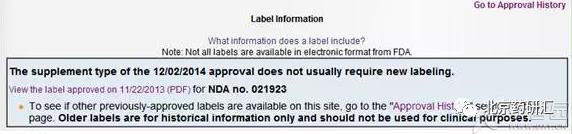
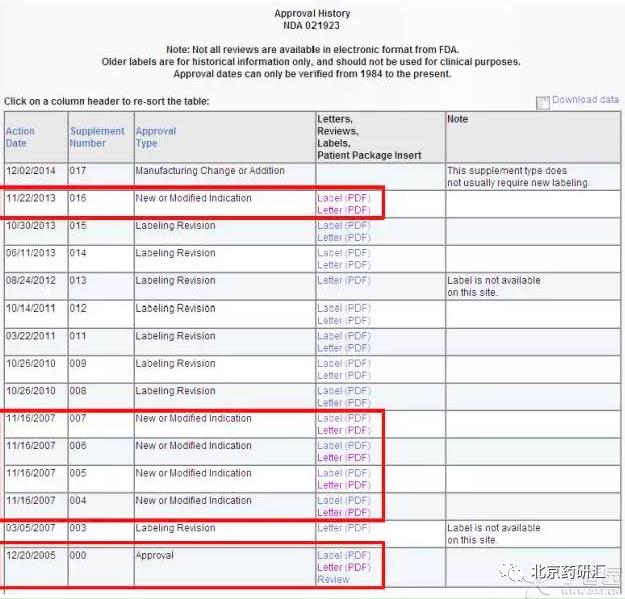
通过标签信息和申请列表,就可以充分发挥我们的侦探才能,理清这个药物从首次获批到现在的历次变更,对应每次变更都有FDA的Letter解释这次变更的原因以及FDA的意见。我们以Sorafenib增加适应症为例。
4、从Sorafenib的最新标签来看,该药先后获批了3个适应症:

5、对应FDA的审评历史发现,2005年12月20日FDA首次批准其治疗无法手术的肝细胞癌,2007年11月16日,FDA批准增加适应症为晚期肾细胞癌,最后在2013年11月22日,增加适应症对放射性碘治疗不再有效的局部复发或转移性、逐步分化型甲状腺癌。
在第四栏中还有一项十分重要的资料:Review。点击可以进入该药的DrugApproval Package。里面有FDA对该药医学、化学、药学、统计学以及临床方面的评审意见,帮助我们了解FDA对这个药,或者这一类药的评审标准。

6、由于Sorafenib还没有仿制药,所以其在DrugDetails页面中显示的是“There is no Therapeutic Equivalents”。为了演示如何寻找新药或仿制药的治疗等效产品,我们选择另一个有仿制品的药物,比如另一种化疗药物Cisplatin
直接跳到Drug Details
7、点击Therapeutic Equivalents
可以看到所有与该原研药治疗等效品,这里一共有5个仿制品。其中FRESENIUS KABI USA的产品被列为RLD,所以如果我们要在FDA申报ANDA,就必须以FRESENIUSKABI USA的产品为参比,我们同时可以参考FDA的Orange Book查找更多信息,而市场上的竞争对手也就是列表中的几家公司了。
以上是关于如何使用美国FDA数据库查询原研药品信息及其应用的主要内容,如果未能解决你的问题,请参考以下文章