CDISC++: DM ~ 重要日期
Posted 迪时咨询
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了CDISC++: DM ~ 重要日期相关的知识,希望对你有一定的参考价值。
今天讨论的重要日期,包括知情同意日期、完成/退出日期、首/末次给药日期、参考开始日期、参考结束日期,都在SDTM的DM(人口学)域中;重点探讨PFENDTC。
RFXSTDTC:首次给药日期/时间
RFXENDTC:末次给药日期/时间
如为多周期设计,如二交叉试验,RFXSTDTC仍然是该受试者在整个研究中(第1周期)的首次给药日期/时间, RFXENDTC是该受试者在整个研究中(最后一个周期)的末次给药日期/时间。
首次给药当天的检查/事件及首次给药,日期时间一定要采集hh:mm部分哟,这样在分析阶段,才能区分这些检查、事件,是发生在给药前(可用作基线)、还是给药后(基线后/给药后的分析)
RFICDTC:知情同意日期/时间
RFPENDTC:参与结束日期/时间
如有多次知情同意,RFICDTC是放最早的那次知情同意日期/时间。
RFPENDTC, 是该受试者在研究中的最晚日期/时间。
RFPENDTC,最好是在《研究总结页》采集,而不是在全部数据里找最大日期哟。
该受试者在研究中最晚日期(RFPENDTC),正确的应该是2021-05-22。如果《研究结束页》[完成/退出日期]填写的是2021-05-15(最后一次常规访视日期),那从数据中找出的最晚日期,就是2021-05-15(错误)。该AE的“仍持续”,正确的表达是2021-05-22时“仍持续”,但数据中是没有这个日期的。(当然后边这个仍持续的日期,也可以在AE页采集,请参看另一篇帖子“AE转归/结束日期”。
RFSTDTC:参照区间开始日期/时间
RFENDTC: 参照区间结束日期/时间
SDTMIG中的描述为“由申办方定义的成对变量,通常为首/末次给药日期”
编者不赞同以上做法,这样RFENDTC是RFXENDTC的完全重复,没任何价值了。
Victor强烈推荐:RFENDTC = RFXENDTC + xx 天;与Treatment Emergent定义一致,同时也与相应EPOCH、Element定义一致。(+xx天,来自方案中对Treatment Emergent的定义或AE采集时限的描述。方案撰写时,可能结合药代动力学特征来制订:如最后一次给药后五个半衰期)。
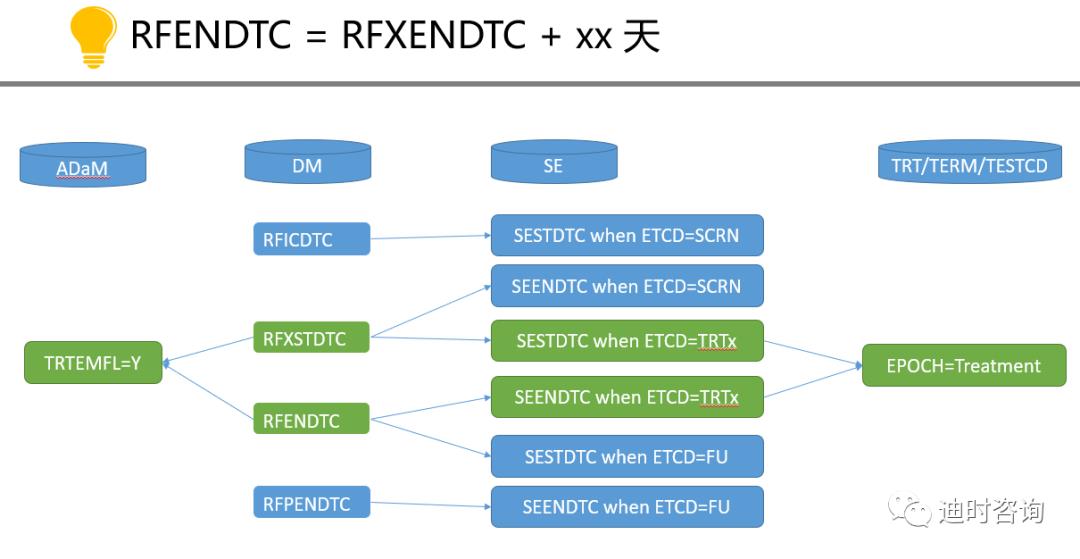

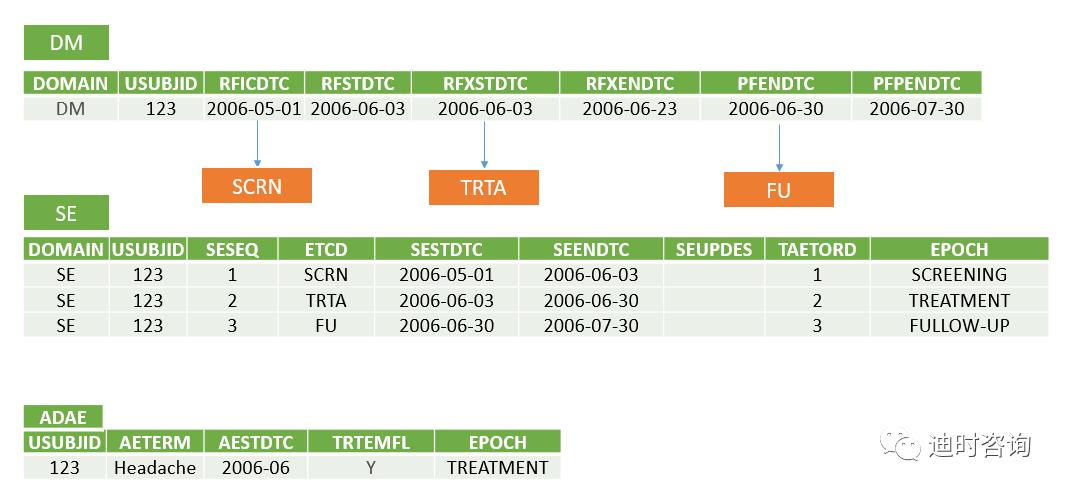
做Trial Design Model/其他SDTM数据集的时候,也同时要考虑后续分析需求 ,这样实施,前后贯通,用起来就更得劲啦,而不只是为了符合CDISC、符合验证规则哟。

如果觉得还不错,欢迎分享、转发哟,是对小编莫大的鼓励

往期推荐
迪时咨询
致力于提供专业的CDISC Solution、基于标准化/规范化的数据管理与统计分析服务。
欢迎交流、垂询:
email: victor.wu@datascie.com
以上是关于CDISC++: DM ~ 重要日期的主要内容,如果未能解决你的问题,请参考以下文章