临床试验虚拟化太难?高手教你怎么做
Posted 医药魔方
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了临床试验虚拟化太难?高手教你怎么做相关的知识,希望对你有一定的参考价值。
快速阅读
临床试验虚拟化问卷调研揭露临床试验中使用eCOA和电子知情同意面临的三大挑战
注册观看《网络课堂: 虚拟试验,远程知情同意,eCOA》助您克服临床试验虚拟化的挑战
亚太地区
在亚太地区,Medidata面向申办者和CRO展开了关于临床试验虚拟化问卷调查,以了解行业内对于使用eCOA/ePro和eConsent的顾虑。
临床试验虚拟化调研共计获得超过250份问卷,27%的受访者表示仅使用纸质的方式采集患者报告数据,而47%的受访者则表示他们同时使用纸质方式和eCOA/ePRO。对于获取知情同意,64%的受访者仅使用纸质知情同意书。
受访者使用eCOA/ePRO三大顾虑分别是数据标准化、规格构建及UAT、运营经验的需求。而使用eConsent的三大顾虑则分别是地区和地方法规、患者数据保护和如何与多方共享电子签名。
使用eCOA/ePRO的三大顾虑
使用eConsent的三大顾虑

欧洲地区
在欧洲地区,Medidata 邀请欧盟监管机构和行业贸易协会参与了一项有关 eConsent 的使用问题的研究, 以了解全球范围内监管机构对于电子知情同意 (eConsent) 的立场、采纳情况和使用差异。其中最受关注的问题包括:
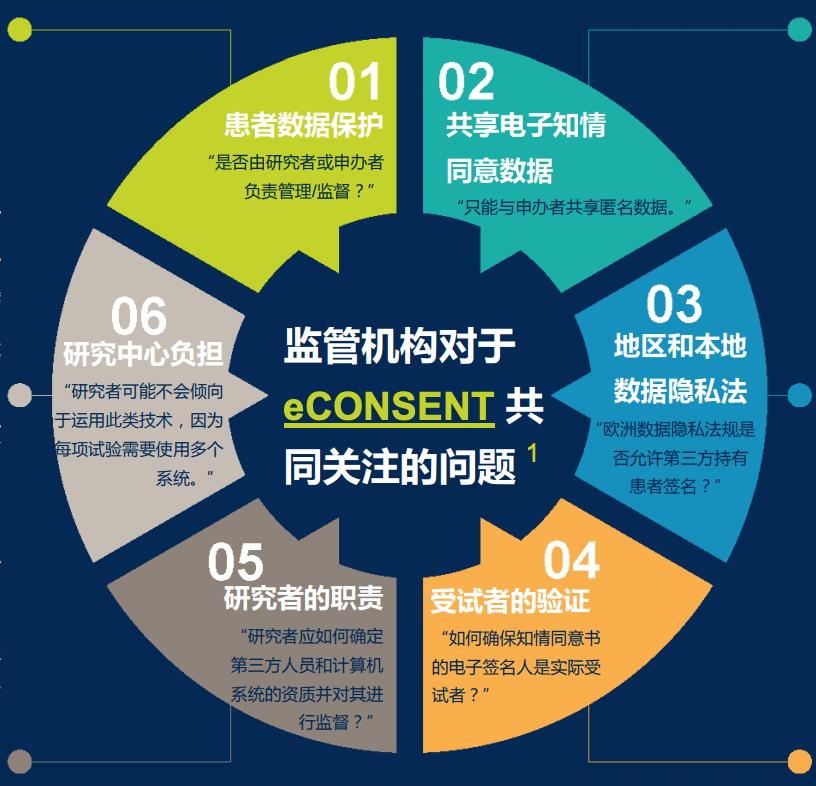
01
患者数据保护
患者的个人可识别信息 (PII) 对申办者设盲,对研究者仅共享去除身份识别信息的数据
02
共享电子知情同意数据
研究中心始终负责管控受试者的 PII,并与申办 者共享匿名数据(用人为的标识符替代信息, 并且无法查看所属的受患者数据保护试者)
03
地区和本地数据隐私法
当 eConsent 供应商与研究者签订直接数据保护协 议或者出于研究者的利益与申办者签订合同时,该供应商应遵守欧盟《通用数据保护条例》(GDPR) 中的规定。Medidata 对 PII 的保护方法是使所有电子记录和签名的稽查记录符合 FDA 和 ICH 指南的要求。
Medidata如何帮助您?
随着 COVID-19 继续肆虐,临床试验无疑受到了显著影响。申办者与 CRO 正克服重重困难继续开展试验,同时还需保护受试者安全与数据完整。
临床试验虚拟化可消除申办者、研究者和受试者在传统临床试验模式中面临的诸多挑战。通过Medidata Patient Cloud 平台实现临床试验虚拟化,助您提高运营效率、可扩展性以及受试者招募率和保留率,从而改善数据质量,降低试验成本。
观看Medidata网络课堂
eCOA ,远程知情同意与试验虚拟化

扫描二维码观看网络课堂: 虚拟试验,远程知情同意,eCOA ,了解如何借助eCOA迅速部署模型助力临床试验,如何选择远程知情同意方式,及如何在当前环境实现试验虚拟化。

扫描二维码观看网络课堂
业务咨询 010 5730 6164
bd.china@medidata.com
技术服务 400 882 2034
APAChelpdesk@medidata.com
以上是关于临床试验虚拟化太难?高手教你怎么做的主要内容,如果未能解决你的问题,请参考以下文章