在滴定分析中,测定常量组分时标准溶液的浓度范围一般是多少?标准溶液的浓度过大或过小各有啥不妥?
Posted
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了在滴定分析中,测定常量组分时标准溶液的浓度范围一般是多少?标准溶液的浓度过大或过小各有啥不妥?相关的知识,希望对你有一定的参考价值。
考虑因素是药典规定常规滴定中,体积读数最后一位是估计值,不是有效数字,但其偏差不应该大于0.01ml,即正负0.01ml。这样说来相对偏差0.1%也是正负0.1%。所以说为达到 准确我们最少应该滴定20ml,以消除这个人为估计的偏差。虽然使用的标准溶液越多越准确,但我们不能无限的增加使用量,从节约的角度和从快速滴定的角度也应该有个限量,因此常用20-30ml。而在这个体积下,一般的50ml的滴定管的准确度也比较高。这在我们日常校正的时候也能看出来。 参考技术A :20-30ml。 考虑因素是药典规定常规滴定中,体积读数最后一位是估计值,不是有效数字,但其偏差不应该大于0.01ml,即正负0.01ml。卡式水分滴定仪预测模型分析

简 介: 对于卡式水分滴定化学过程进行分析。
关键词: 卡式水分滴定
▌01 卡式水分滴定
1.基本原理
卡式水分测定(Karl Fischer Titration) 广泛应用在工业、电子、化妆品、医药、食品等领域。 KF化学反应方程式:
C
H
3
O
H
+
S
O
2
+
R
N
→
[
R
N
H
]
S
O
3
C
H
3
CH_3 OH + SO_2 + RN \\to \\left[ {RNH} \\right]SO_3 CH_3
CH3OH+SO2+RN→[RNH]SO3CH3
H
2
O
+
I
2
+
[
R
N
H
]
S
O
3
C
H
3
→
[
R
N
H
]
S
O
4
C
H
3
+
2
[
R
N
H
]
I
H_2 O + I_2 + \\left[ {RNH} \\right]SO_3 CH_3 \\to \\left[ {RNH} \\right]SO_4 CH_3 + 2\\left[ {RNH} \\right]I
H2O+I2+[RNH]SO3CH3→[RNH]SO4CH3+2[RNH]I
-
KF滴定试剂主要成分:
-
Ioine (碘): I 2 I_2 I2
Solpher dioxide:(二氧化硫) : S O 2 SO_2 SO2
Buffer(缓冲剂): I m i d a z o l e {\\mathop{\\rm Im}\\nolimits} idazole Imidazole(咪唑,异吡唑)
Solvent(溶剂): Methanol(甲醇)、Ethanol(乙醇)
在不同的pH范围下,KF滴定反映速度:
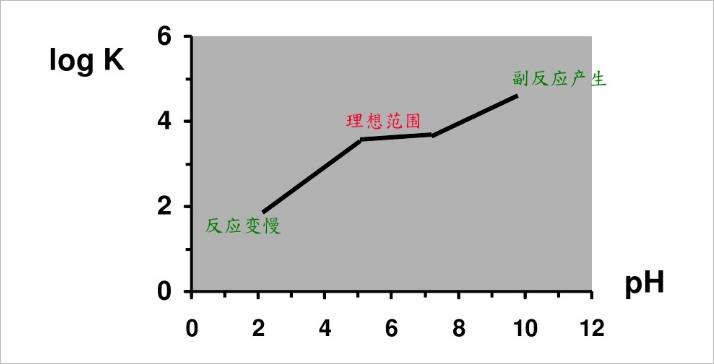
▲ 不同PH下的KF反应速度
理想滴定pH值为 : ph5 ~ pH7范围内。
2.基本的滴定方法
(1)KF容量滴定方法
使用KF标准滴定液(力价5,力价2,力价1)KF标准液分析水分的含量。这种方法应用在样品含税比例高的情况下。比如 0.1% ~ 100% (100ppm ~ 100000 ppm)。
▲ KF容量滴定方法
容量滴定的方法:
T i t e r ( m g / m l ) = S a m p l e ( m g ) K . F . R ( m l ) Titer\\left( {mg/ml} \\right) = {{Sample\\left( {mg} \\right)} \\over {K.F.R\\left( {ml} \\right)}} Titer(mg/ml)=K.F.R(ml)Sample(mg)
滴定液的力价值,反映了每毫升滴定液可以反应多少的水分:比如力价5的滴定液,每毫升可以消耗5mg的水分。往往这个比值需要在滴定前进行标定。
(2)KF库伦碘量法
电解1mol水分需要多少库伦电量来测量相关反应。这种方法应用在微量水分(ppm)测量范围内。 适用范围 0.001% ~ 1$ (1ppm ~ 1000ppm)。
1F(法拉第)=96’485 colomb/mol 有 259.8g/mol的 碘(I2)被释放与水18.02 g/mol 反应。

▲ KF库伦法滴定装置
3.滴定判断
判断滴定是否终结,也就是判断滴定液中是否已经没有水分,是利用铂电极在溶液中的导通电流来判断。在铂电极上施加10mV左右的偏执电压。如果溶液中存在碘分子,则会产生很大的电流。如果溶液中的碘分子都被试剂中的水分反映完,则导通电流为0。

▲ 滴定所使用的铂电极
滴定过程中,测量最后水分刚刚中和完时所使用的滴定液的量决定了测量结果的精度。因此在最后滴定过程中,需要非常少的加液量,以便逐步精确逼近滴定终点。
在滴定前期,为了能够提高滴定速度,需要能够大剂量加入滴定液,但一定需要保证所施加的滴定液不能够超过滴定终点所需要的加液量,否则本次滴定就会失败。那么如何能够判断出滴定杯中的水量,对于所需要的滴定液的需求呢?
以上是关于在滴定分析中,测定常量组分时标准溶液的浓度范围一般是多少?标准溶液的浓度过大或过小各有啥不妥?的主要内容,如果未能解决你的问题,请参考以下文章