Stress-induced changes in the S-palmitoylation and S-nitrosylation of synaptic proteins (解读人:陈凌云)(示例
Posted ilifeiscience
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了Stress-induced changes in the S-palmitoylation and S-nitrosylation of synaptic proteins (解读人:陈凌云)(示例相关的知识,希望对你有一定的参考价值。
文献名:Stress-induced changes in the S-palmitoylation and S-nitrosylation of synaptic proteins (压力诱导突触蛋白的S-棕榈酰化和S-亚硝基化的改变)
期刊名:Mol Cell Proteomics
单位:Laboratory of Cell Biophysics, Nencki Institute of Experimental Biology, Polish Academy of Science, 02-093 Warsaw, Poland
技术:蛋白质组修饰的鉴定
一、概述
本研究利用一种新开发的基于质谱的棕榈酰化和亚硝基化相互作用监控(Palmitoylation And Nitrosylation Interplay Monitoring ,PANIMoni)的方法,分析了在慢性束缚应激小鼠模型中突触后密度蛋白的内源性S-棕榈酰化和S-亚硝基化。总共鉴定813个S-棕榈酰化和620个S-亚硝基化半胱氨酸位点,分别在465和360个蛋白上,并试图找出这些受到压力不同影响的位点。根据数据分析显示S -棕榈酰化和S-亚硝基化交互作用参与了122种蛋白的调控,包括受体蛋白、支架蛋白、调控蛋白和细胞骨架成分。
二、研究背景
突触完整性的精确调控对神经元网络连接和大脑正常功能至关重要。突触蛋白活动和定位的是由翻译后修饰来调控的。S-棕榈酰化是半胱氨酸与棕榈酸盐的可逆共价修饰。它调节蛋白质对细胞膜和膜室的亲和力。细胞内的棕榈酰化动力学是通过与其他翻译后修饰(如S-亚硝基化)的相互作用来调节的。S-亚硝基化是半胱氨酸硫醇与一氧化氮的共价修饰,具有调节蛋白质功能。因此,在一定的生物学条件下,同时鉴定这两种修饰的内源性位点的特异性蛋白组可以为调控功能通路提供了新的思路。
三、实验设计

四、研究成果
1.初级神经元中S-棕榈酰化和S-亚硝基化的交互作用
用压力激素肾上腺皮质脂酮处理小鼠皮质神经元,通过WB和原位细胞成像,发现肾上腺皮质脂酮增加了培养神经元的S-棕榈酰化蛋白的水平。但是用一氧化氮供体SNAP处理培养神经元引起了蛋白快速的S-亚硝基化或S-棕榈酰化抑制剂2-溴丙二酸盐(2Br)的作用,从而降低了S-PALM的整体水平。另外一氧化氮合成酶抑制剂并不会影响蛋白的S-棕榈酰化,表明不是一氧化氮而是蛋白的S-亚硝基化影响突触蛋白的S-棕榈酰化。升高的S-棕榈酰化是神经元对高水平肾上腺皮质脂酮的反应的一个因素,可以通过S-亚硝基化来调节。
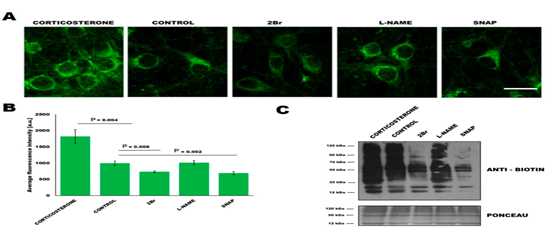
2. 突触棕榈酰化蛋白质组
利用PANIMoni方法分析突触密度蛋白S-棕榈酰化修饰,鉴定到705个S-棕榈酰化半胱氨酸位点在404个从小鼠大脑分离的不同的突触密度蛋白。
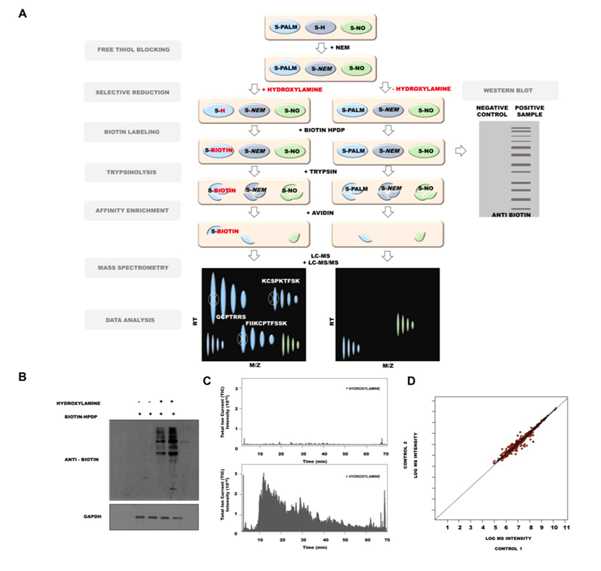
3. 应激相关疾病动物模型中S-棕榈酰化的动态变化
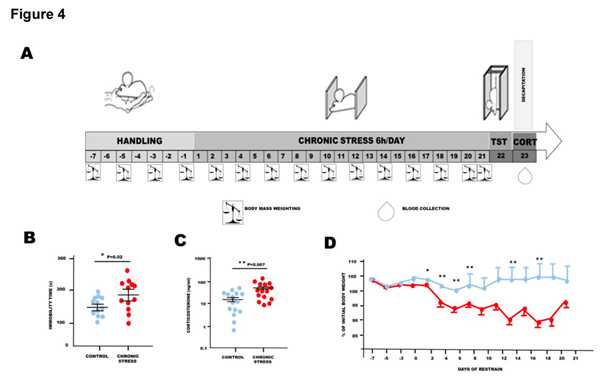
利用定量蛋白质组学的方法(label-free coupled with 2D heat-map 分析)进行小鼠大脑蛋白表达变化的分析,在慢性束缚应激小鼠脑部的突触后密度蛋白中鉴定到1247蛋白质簇包含1639个蛋白。PCA等分析对照组和慢性束缚应激组鉴定到的突触后密度蛋白,描述了慢性束缚应激后小鼠大脑中S-棕榈酰化蛋白的变化。在已鉴定的465个S-棕榈酰化突触后密度蛋白中,仅在对照组中发现了3个,对照组和应激小鼠中S-棕榈酰化肽的数量与差异蛋白的数量有着明显不同 。
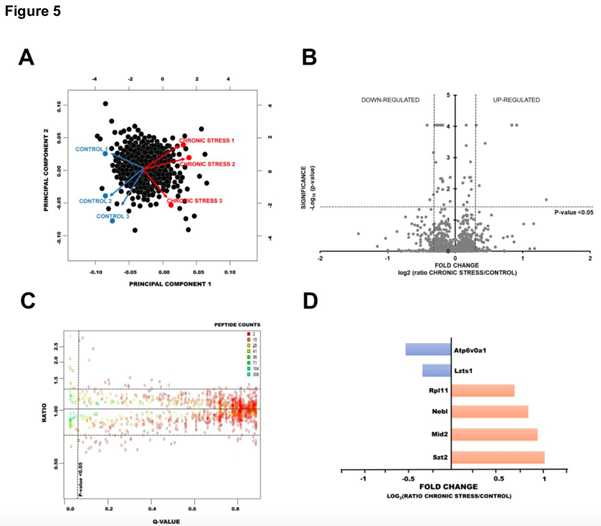
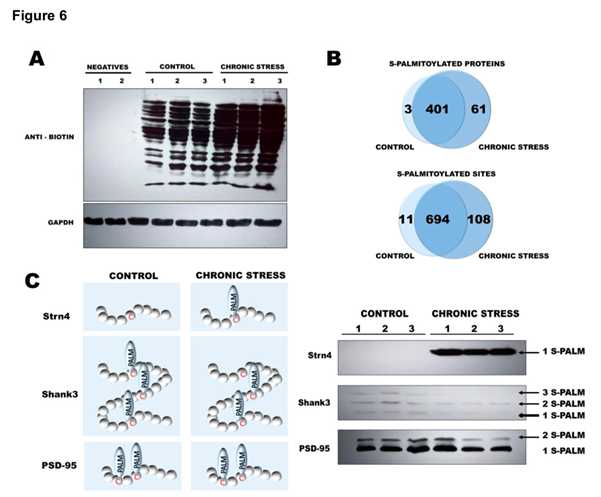
4. 动态S-棕榈酰化调控机制
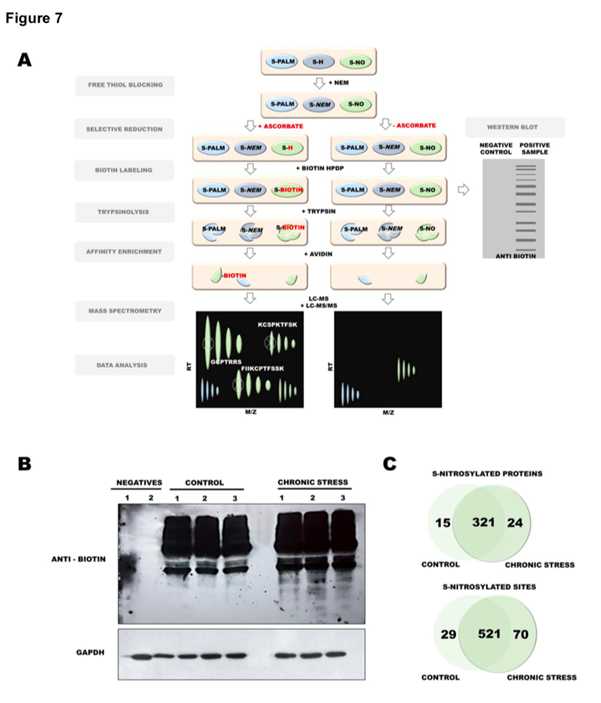
通过对慢性束缚应激下不同蛋白的S-亚硝基化的分析,总共鉴定到602各S-亚硝基半胱氨酸位点在360各蛋白中,其中107个位点是第一次鉴定到。在446个经修饰的PSD蛋白中,42个为S-亚硝基化,109个为S-棕榈酰化。在778个半胱氨酸中,295个半胱氨酸仅以S-PALM形式出现(在198个蛋白质中),75个以S-NO形式出现(在61个蛋白质中)。慢性压力通常会导致更多的半胱氨酸位点发生S-PALM和S-NO修饰。有趣的是,在慢性应激小鼠中,在464种已被鉴定的修饰蛋白中,只有2种蛋白与一氧化氮完全相关,119种蛋白与棕榈酸盐完全相关。在比较总共鉴定的813个S-PALM和620个S-NO半胱氨酸位点, 分别在465和360个蛋白质上,122个修饰蛋白的S-棕榈酰化和S-亚硝基化是由慢性应激引起的。
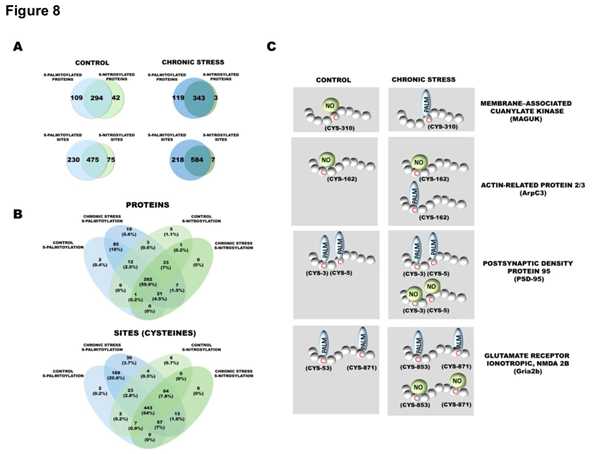
5. S-棕榈酰化和S-亚硝基化影响各种突触后密度蛋白的功能
通过GO和KEGG分析突触后密度蛋白S-棕榈酰化/亚硝基化改变的生物学意义和功能意义。这些分析揭示了压力导致的S-棕榈酰化/亚硝基化交互改变在蛋白中的显著程度,而这些蛋白在正常的突触功能中起着关键的作用。
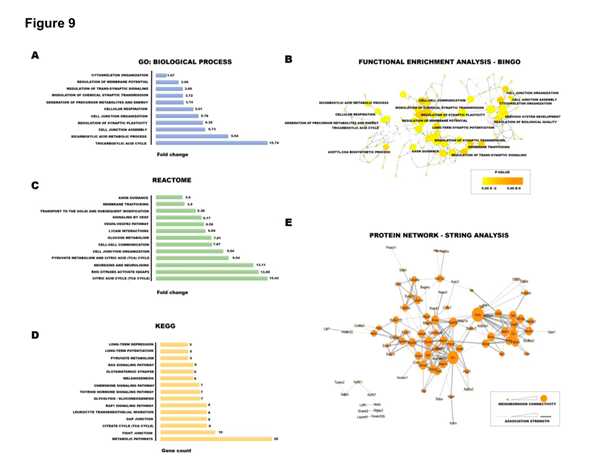
五、研究亮点
之前关于S-棕榈酰化和S-亚硝基化在突触蛋白中研究仅限于单个蛋白和单种修饰,没有考虑复杂生理状态下S-棕榈酰化/亚硝基化交互改变的整体效应。本研究利用PANIMoni 的方法,能够在小鼠大脑的突触后密度蛋白中对半胱氨酸的S-棕榈酰化和S-亚硝基化修饰进行大规模分析。有助于研究参与突触传递、蛋白定位和突触可塑性调控的蛋白质之间的S-棕榈酰化和S-亚硝基化相互作用。
阅读人:陈凌云
以上是关于Stress-induced changes in the S-palmitoylation and S-nitrosylation of synaptic proteins (解读人:陈凌云)(示例的主要内容,如果未能解决你的问题,请参考以下文章