精选回顾
Posted 爱基百客
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了精选回顾相关的知识,希望对你有一定的参考价值。
组蛋白+DNA组成核小体,核小体又是染色体的基本单位。组蛋白在N端有一段“尾巴”,组蛋白修饰通常发生在这些尾巴上面。组蛋白修饰是以共价方式进行的蛋白质翻译后修饰,常见的修饰包括甲基化、磷酸化、乙酰化和泛素化等,近年来发现了不少新型修饰类型,比如丙酰化、丁酰化、2-羟基异丁酰化、琥珀酰化、丙二酰化、戊二酰化、巴豆酰化、β-羟基丁酰化和乳酸化。不同的修饰类型以及修饰的位置构成了组蛋白修饰的功能多样性。
更多文章
了解组蛋白修饰并阐明其调控机制在很多科研领域都有重要意义。近些年,组蛋白修饰方面的研究与日俱增,最明显的证据就是在pubmed数据库中与日俱增的文章数量。
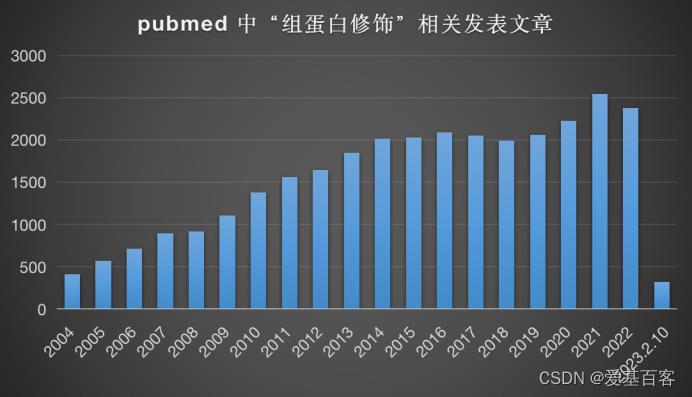
以“histone modification”检索pubmed数据库
组蛋白修饰也一直是近些年的国自然热点,2022年度国自然医学方向“组蛋白”、“乙酰化”、“乳酸化”、“增强子”等热点都与组蛋白修饰密切相关。本期小爱精选了2022年的几篇组蛋白修饰的项目文章,涉及不同物种、修饰以及功能,希望给大家的科研带来一些思路。
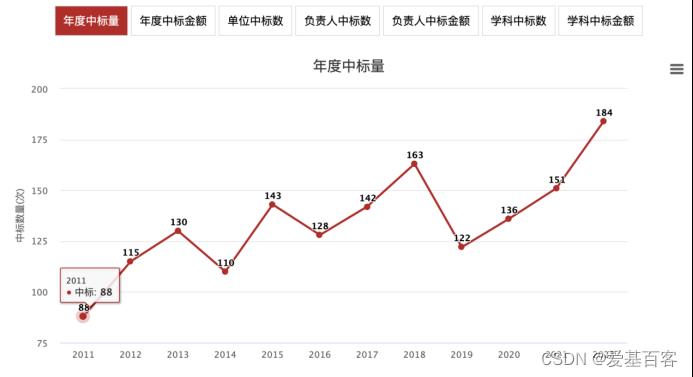
组蛋白相关的国自然中标数逐年上升(ZCOOL国家自然科学基金)
01 植物免疫和组蛋白乙酰化
一种分泌真菌效应器通过宿主组蛋白低乙酰化抑制水稻免疫
A secreted fungal effector suppresses rice immunity through host histone hypoacetylation
发表期刊:New Phytol|影响因子:10.323
发表单位:华中农业大学|抗体类型:H3K9ac
研究背景
植物与病原菌互作过程中,植物本身进化出一套有效的先天免疫系统来抵御病原菌的侵染,主要包括PTI(PAMP-triggered immunity)和ETI(Effector-triggered immunity)两个免疫层次。病原菌为了成功侵染植物会分泌大量效应蛋白来抑制植物的免疫反应,发挥毒性功能。此前研究表明,组蛋白乙酰化是调节植物免疫的一种重要表观遗传修饰,但病原真菌是否进化出直接靶向植物组蛋白乙酰化的效应蛋白尚不清楚。
研究结果
在本研究中,作者首先联合稻曲菌分泌组和转录组数据,选取19个候选分泌蛋白进行基因敲除,接种后发现分泌蛋白UvSec117的基因敲除突变体致病力显著减弱,qRT-PCR和表型观察分析说明UvSec117是致病所必需的。在水稻中异源超表达UvSec117,35S-UvSec117转基因水稻对稻曲病、稻瘟病和白叶枯病更为感病,且转基因水稻中H3K9乙酰化修饰水平显著降低,表明UvSec117干扰了水稻H3K9乙酰化修饰。
ChIP-seq鉴定发现35S-UvSec117转基因水稻中H3K9乙酰化修饰调控的靶基因数量显著减少,qRT-PCR和ChIP-PCR证明35S-UvSec117转基因水稻中H3K9乙酰化修饰调控的抗病相关基因表达量显著降低,说明UvSec117通过影响水稻组蛋白H3K9乙酰化修饰干扰抗病基因表达。
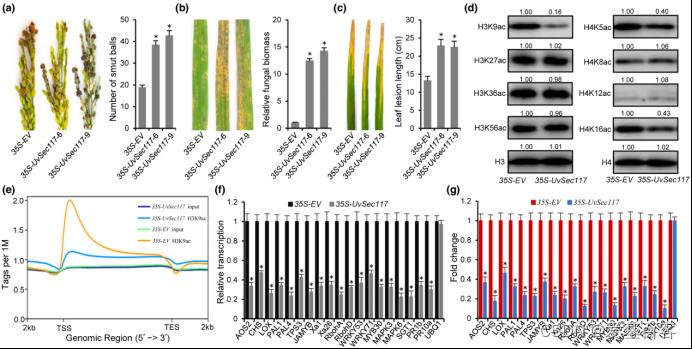
图UvSec117通过调节H3K9ac标记的基因抑制水稻免疫
查看原文:项目文章 | New Phytol & Small RNA-seq和ChIP-seq联合分析助力揭示稻曲菌抑制水稻免疫的新机制
02 植物株高与组蛋白泛素化
水稻OsUBR7通过调节组蛋白H2B单泛素化和细胞增殖来调节株高
Rice OsUBR7 modulates plant height by regulating histone H2B monoubiquitination and cell proliferation
发表期刊:Plant Commun|影响因子:8.625
单位:华南农业大学|抗体类型:H2Bub1
研究背景
表观遗传修饰,如DNA甲基化和组蛋白修饰,通过调控转录活性在真核生物的多种细胞过程和发育中发挥重要作用。由蛋白质编码和非编码基因控制的表观遗传多样性可能为作物改良提供额外的变异来源。蛋白连接酶E3 成分N-Recognin7(UBR7),以及这种类型的E3连接酶使用其独特的UBR7锌指结构单泛素化H2B,通过调控细胞粘附基因抑制乳腺肿瘤的发生和转移。然而,植物UBR7同系物是否行使组蛋白修饰功能,以及它们是否调节株高和发育仍然不清楚。
研究结果
作者在水稻突变体库中发现了一个人UBR7的同系物Os06g0529800,构建突变体,表型结果证实OsUBR7调控水稻株高。为了找出OsUBR介导组蛋白修饰转录激活的基因,作者在野生型和osubr7突变体幼苗中进行ChIP-seq和转录组测序。ChIP-seq的结果显示osubr7 vs WT的差异分析中1654个基因位点的H2Bub1水平(1695个peaks)下调,数目高于上调的H2Bub1水平(253个peaks)的基因。这些差异peaks分布在整个基因组上。选择2个多效性基因和2个细胞周期相关基因做ChIP-qPCR验证,证明这些基因位点的H2Bub1水平确实是减少的(图5B)。这些结果暗示OsUBR7确实在一些染色质位点充当H2B单泛素化的功能。
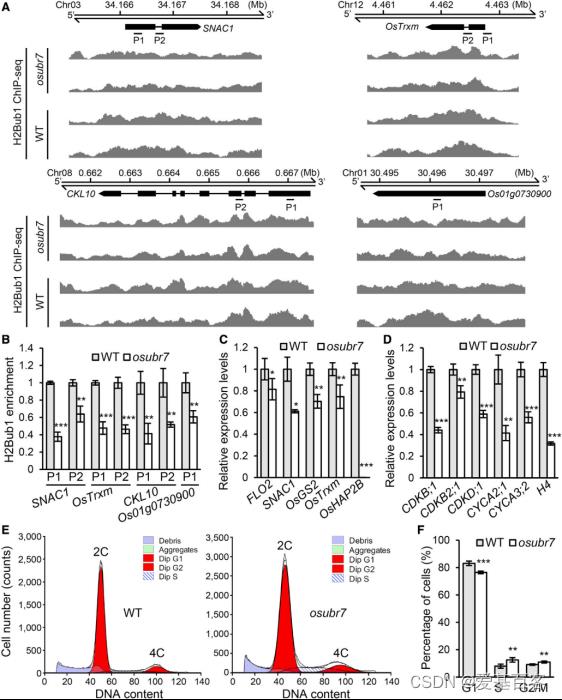
图 由OsUBR7介导的H2Bub1减少下调靶基因表达导致细胞周期进程的抑制
查看原文:客户文章 | Plant Commun华南农大刘耀光院士团队发表水稻株高调控的组蛋白修饰机制
03 鸡卵泡和组蛋白乙酰化
鸡卵泡发生过程中颗粒细胞的动态转录组和染色质结构
Dynamic transcriptome and chromatin architecture in granulosa cells during chicken folliculogenesis
发表期刊:Nature Commun|影响因子:17.694
单位:四川农业大学|抗体类型:H3K27ac
研究背景
卵泡发生是一个复杂的生物学过程,涉及中心卵母细胞及其周围体细胞。三维染色质结构是重要的转录调控因子;然而,其在鸡卵泡发育过程中颗粒细胞的动态和对转录调控作用知之甚少。
研究结果
作者研究了10个卵泡阶段的鸡颗粒细胞的转录组动力学,并评估了染色质结构动力学,以及它如何影响三个关键阶段(分级前小白卵泡、第一个最大的排卵前的卵泡和排卵后期卵泡)颗粒细胞中的基因表达。研究结果证明了卵泡发育过程中染色质结构的整体重编程和转录组差异之间的一致性,为区室重排、拓扑关联域的可变组织以及启动子和增强子之间长距离相互作用的重连接提供了充分的证据。这些结果为鸟类生殖生物学提供了重要的见解,并为未来颗粒细胞功能的深入表征提供了基础数据集。在该研究中是联合Hi-C、ATAC-seq、ChIP-seq和RNA-seq数据分析了鸡卵泡发育过程中颗粒细胞启动子和增强子的全局重连接。
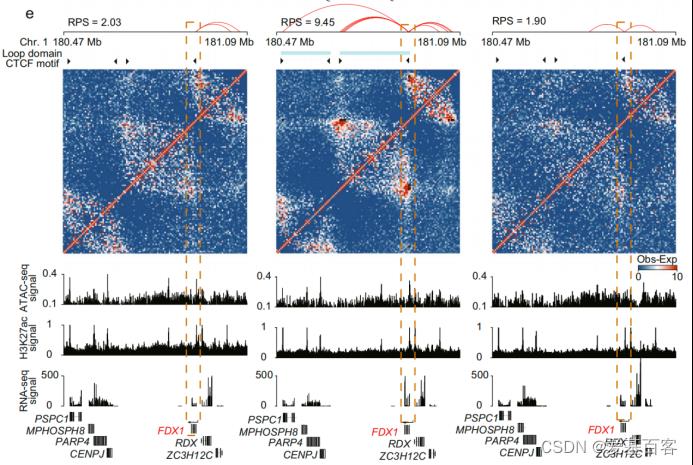
图 在卵泡发生过程中,一个功能基因FDX1(红色)的PEI(启动子-增强子互作)重连接。
查看原文:客户文章 | Nature Communication鸡卵泡发育过程中颗粒细胞的转录组动态和染色质结构
04 真菌毒素合成代谢和毒力与组蛋白甲基化
Set2家族通过H3K36甲基化调控病原真菌黄曲霉的真菌毒素代谢和毒力
Set2 family regulates mycotoxin metabolism andvirulence via H3K36 methylation in pathogenic fungus Aspergillus flavus
发表期刊:Virulence|影响因子:5.428
单位:福建农林大学|抗体类型:H3K36me3
研究背景
黄曲霉以黄曲霉毒素感染各种作物,并适时地导致曲霉病。H3K36甲基化在真菌的次生代谢和毒力中起着重要作用,但H3K36甲基化对黄曲霉毒力的调控机制尚未见报道。作为一种新的组蛋白甲基转移酶(HMT),Set2通过其在酿酒酵母中的SET结构域催化H3K36的单、二和三甲基化,而最近的研究表明,H3K36的三甲基化是由Set2和Ash1(Set2家族)的催化活性引起的。考虑到Set2家族成员在维持常染色质位置的巨大影响,阐明Set2家族在致病性曲霉属次级代谢和毒力中的生物学功能至关重要。
研究结果
本研究发现H3K36的三甲基化在双缺失菌株中被终止。为了发现H3K36me3调控黄曲霉毒素合成和真菌毒力的机制,以ΔsetB/ashA菌株为对照,进行ChIP-seq分析,富集WT菌株H3K36me3修饰的染色质片段。富集peaks分布分析表明WT菌株vs ΔsetB/ashA菌株上调富集峰分布在黄曲霉全基因组上。WT菌株中大部分上调富集峰定位于外显子(46.88%)和启动子(41.25%)区域。对Peaks关联基因进行分析,结果表明H3K36me3与该研究揭示的代谢过程、信号转导、生物调控、增殖和生长等各种重要生物过程的调控密切相关。
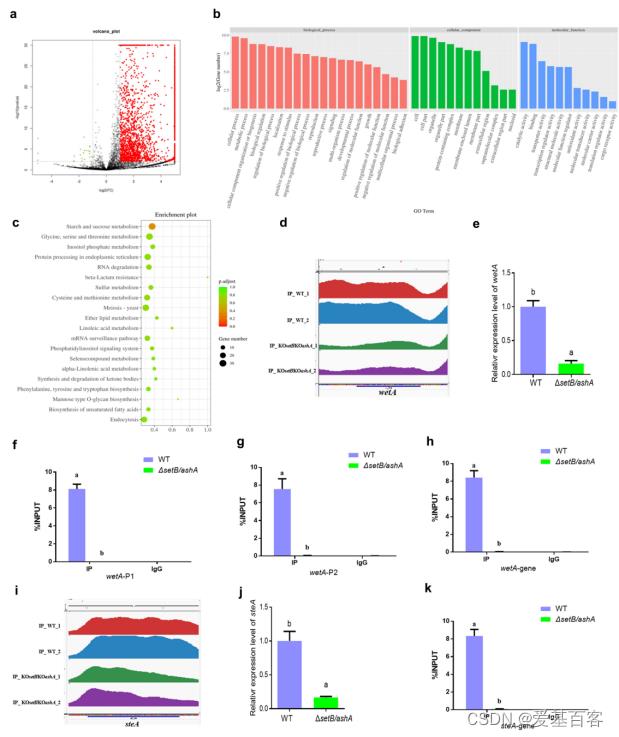
图 SetB和AshA通过催化H3K36的三甲基化来调控AFB1的生物合成
查看原文:项目文章 | ChIP-seq揭示Set2家族通过H3K36甲基化调控病原真菌黄曲霉的真菌毒素代谢和毒力
05 真菌发育和致病性与组蛋白乙酰化
Fng3 ING蛋白通过与两种不同的组蛋白修饰复合物互作调节H3乙酰化和H4去乙酰化
The Fng3 ING protein regulates H3 acetylation and H4 deacetylation by interacting with two distinct histone-modifying complexes
发表期刊:New Phytol|影响因子:10.323
单位:西北农林科技大学|抗体类型:H3K14ac
研究背景
组蛋白乙酰化的稳态水平由组蛋白乙酰转移酶 (HAT) 和组蛋白去乙酰化酶 (HDAC) 复合物维持。生长抑制剂 (ING) 蛋白是 HAT或HDAC复合物的关键成分,但它们与其他成分的关系以及在植物病原真菌中的作用尚不清楚。真菌中对此类蛋白的认知主要来源于酵母,对丝状真菌生长抑制因子蛋白的功能仍知之甚少。
研究结果
该研究鉴定了一个仅在子囊菌中存在的生长抑制因子Fng3通过Nto1与NuA3组蛋白乙酰化复合体核心亚基FgSas3互作,介导对组蛋白H3乙酰化的调控。RNA-seq、ChIP-seq和组蛋白乙酰化联合分析表明Fng3在调控H3乙酰化的同时,还参与了对组蛋白H4的去乙酰化调控。该研究发现丝状真菌的生长抑制因子与组蛋白修饰之间存在独特的互作与调控模式,为认识不同组蛋白修饰间的关系提供了新见解。
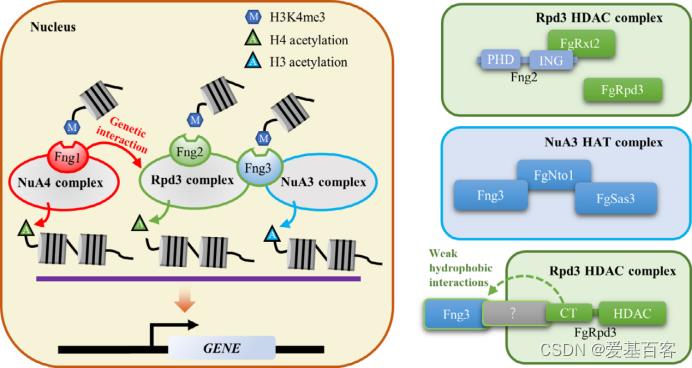
图 禾谷镰刀菌生长抑制剂(ING)蛋白调控组蛋白乙酰化的示意图模型
查看原文:项目文章 | IF=10.323!Fng3 ING蛋白调控丝状真菌组蛋白H3、H4乙酰化动态平衡新机制
检测组蛋白修饰的组学方法有ChIP-seq和CUT&Tag,爱基百客在常规组蛋白修饰和新型组蛋白修饰都有项目经验,目前ChIP-seq和CUT&Tag正在做开学大促的活动,有需求的老师欢迎来勾搭哟~
参考文献
1. Chen X, Duan Y, Qiao F, et al.. A secreted fungal effector suppresses rice immunity through host histone hypoacetylation. New Phytologist. 2022;235(5):1977–1994.
2. Zheng YY, Zhang SS, Luo YQ, et al. Rice OsUBR7 modulates plant height by regulating histone H2B monoubiquitination and cell proliferation. Plant Communications. 2022; 3(6):100412.
3. Li D, Ning C, Zhang J, et al. Dynamic transcriptome and chromatin architecture in granulosa cells during chicken folliculogenesis. Nat Commun.2022; 13:131.
4. Zhuang ZH, Pan XH, Zhang MJ, et al. Set2 family regulates mycotoxin metabolism and virulence via H3K36 methylation in pathogenic fungus Aspergillus flavus. Virulence. 2022; 13(1):1358-1378.
5. Xu H, Ye M, Xia A, et al. The Fng3 ING protein regulates H3 acetylation and H4 deacetylation by interacting with two distinct histone modifying complexes. New Phytol. 2022; 235(6):2350-2364.
以上是关于精选回顾的主要内容,如果未能解决你的问题,请参考以下文章