《自然·医学》重磅:人工智能牛大了!深度学习算法竟可直接从病理切片识别基因组不稳定,或可指导免疫治疗 | 科学大发现
Posted 奇点网
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了《自然·医学》重磅:人工智能牛大了!深度学习算法竟可直接从病理切片识别基因组不稳定,或可指导免疫治疗 | 科学大发现相关的知识,希望对你有一定的参考价值。
人工智能真是太厉害辣!
今天《自然医学》杂志发布了一项来自德国亚琛工业大学医院的科研成果[1],研究者们利用人工智能搞了一个大事儿——直接从病理切片识别微卫星不稳定(MSI)。研究利用了深度残差学习算法,识别结直肠癌MSI准确率达到84%!考虑到MSI在各癌种中的普遍性,后续潜力无限~
这意味着我们或许可以跳过免疫组化或基因检测,直接利用机器提取组织特征,对病理切片进行分析,更加方便、快捷地识别出那些适合使用免疫治疗的患者。

图源 | pixabay
所谓微卫星(microsatellite)指的是基因组中一些短的重复的DNA序列,微卫星不稳定(microsatellite instability,MSI)与DNA错配修复相关。已经有很多研究证实,MSI与多种癌症相关,尤其是结直肠癌等胃肠道癌症。
有意思的是,在免疫治疗上获益并不很明显的胃肠道肿瘤[2],当绑定上了MSI,便能够受免疫检查点抑制剂的福泽[3],这一点近期也被FDA认可。
那么,如何找到胃癌(STAD)和结直肠癌(CRC)中的这15%[4]的MSI患者,就成了关键。
技术上,检测MSI不算难,免疫组化分析(IHC)或基因检测就可以做到。但是目前只有在水平比较高的医学中心才会进行MSI常规检查,很多患者就这样错过了用上免疫治疗的机会。
有没有更简单、快捷、高效的方法呢,比如说,已经在、前列腺癌、脑癌方面取得“慧眼识突变”成就的深度学习?[5-7]
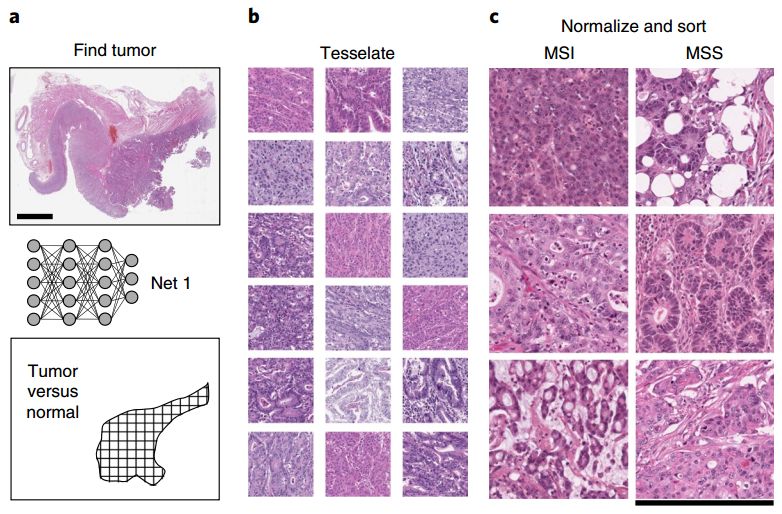
MSI和MSS的组织样本
研究者在一个小样本数据集中测试了5种不同的算法,最终名为Resnet18[8]的深度残差学习(deep residual learning)算法脱颖而出,曲线下面积(AUC)竟然高于0.99。深度残差学习采用跳跃链接方法,对有效数据保留更好,同时结构更加简单,训练速度也更快。
选定了算法,研究者从癌症基因组图谱(TCGA)中获取了病理切片数据,包括315个福尔马林固定石蜡包埋(FFPE)胃癌样本(TCGA-STAD),360个FFPE结直肠癌样本(TCGA-CRC-DX)和378个冷冻结直肠癌样本(TCGA-CRC-KR)。
这些样本又进一步经过自动肿瘤检测仪处理,分别生成了100570、93408、60894个颜色归一化色块,作为深度学习的“原料”,随后分别对MSI和MSS(微卫星稳定)样本进行MSI评分。
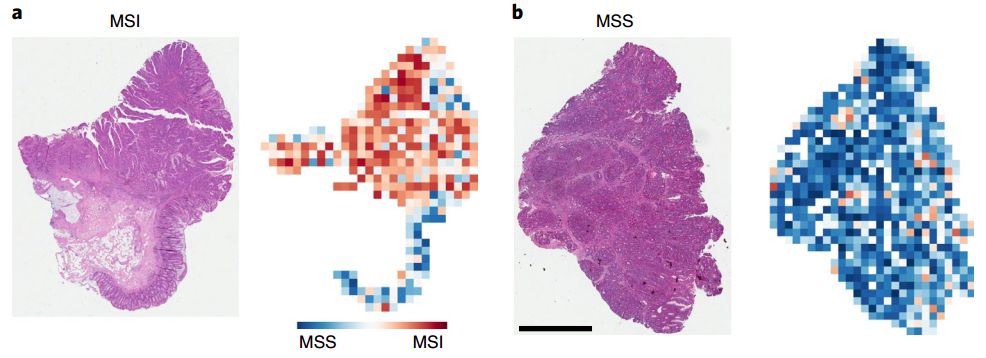
组织样本与颜色归一化色块
测试结果显示,针对FFPE结直肠癌样本,MSI图像的MSI评分为0.61,MSS图像的MSI评分为0.29;对于冷冻的结直肠癌样本,二者数据分别为0.5和0.22。可见该算法并不受样本处理方法的限制,都有足够的区分度。
再看准确性,对胃癌、FFPE结直肠癌和冷冻结直肠癌三组样本,AUC则分别达到0.81、0.84、0.77。
接下来,研究者对算法进行了三次外部验证。
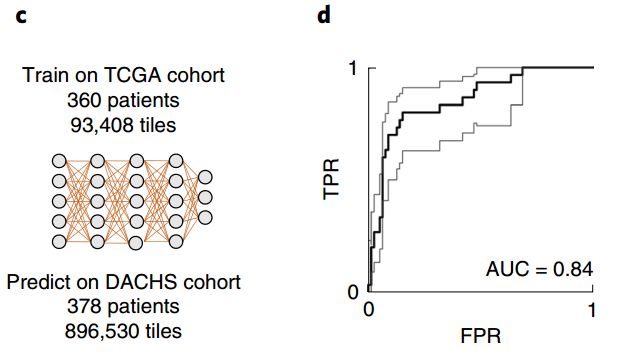
第一组样本数据来自DACHS研究,包括378份样本,使用FFPE结直肠癌样本训练出的模型,AUC达到了0.84!研究者还尝试了用冷冻样本训练出的模型和胃癌样本训练出的模型,效果均略有不足,说明模型准确性受到组织类型和样本处理方法的影响。
第二组数据来自日本横滨的KCCH队列。选择它的原因主要是亚裔的胃癌组织学和临床过程与非亚裔差别很大[9]。来自TCGA的胃癌样本中有80%是非亚裔,100%亚裔的KCCH队列(n=185)验证结果AUC为0.69。
考虑到MSI是一种泛癌种的生物标志,研究者选了第三组数据,来自UCEC队列的327个子宫内膜癌样本。经训练的模型在剩余样本中AUC为0.75。
由此可见,这种算法模型可能受癌种、样本类型、患者人种的影响,如果要拓展使用,可能需要更大的数据集来训练。
研究者还计算了该检测需要的组织样本大小,结果显示下限约为100×256μm见方。这个大小的组织通过活检就可以取得,可以说是非常方便了。
最后,研究者对比了模型计算的MSI评分与转录组和免疫组化数据的差异。相关区域胃癌的淋巴细胞基因特征、结直肠癌的PD-L1和IFN-γ表达、肿瘤低分化、免疫细胞浸润等特征都是符合组织病理学理论的。
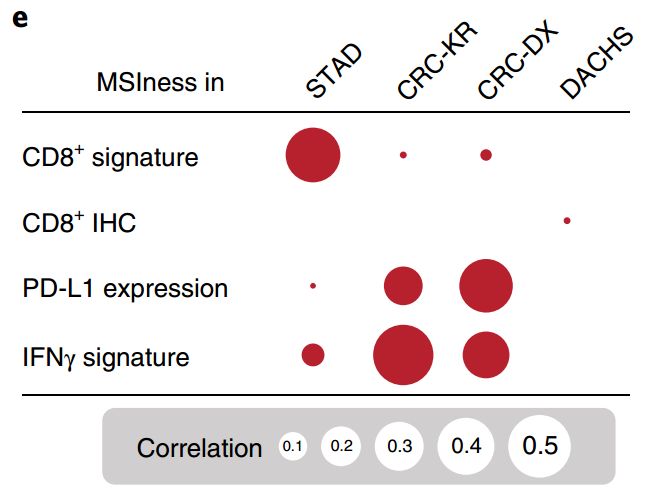
MSI评分与免疫组化/转录组数据相关性
癌症的免疫治疗开拓了一片新天地,不过至今寻找能从免疫治疗获益的患者仍旧是关键难题。正在召开的ASCO也把寻找新的免疫治疗生物标志物列为2019年研究首要任务。

图源 | ASCO.org
而现有的生物标志物检测也远还没有惠及到大多数患者。
人工智能可能是解决这一问题的最好方案。低成本、无需额外的实验过程、样本方便获取……相信经过更大数据集的训练和前瞻性验证,它能够真正把免疫治疗带向更多人。
编辑神叨叨
五体投地.jpg
ASCO报道极速更新,专题精选最值得关注研究,一键直达不可错过哦~
瞬息 尼拉帕利+贝伐单抗活性更强,复发性铂敏感性卵巢癌(PSROC)患者获益
小程序
参考资料:
[1]https://www.nature.com/articles/s41591-019-0462-y
[2] Darvin, P., Toor, S. M., Sasidharan Nair, V. & Elkord, E. Exp. Mol. Med. 50, 165 (2018).
[3] Le, D. T. et al. N. Engl. J. Med. 372, 2509–2520 (2015).
[4] Bonneville, R. et al. JCO Precis. Oncol. 2017, 1–15 (2017).
[5] Coudray, N. et al. Nat. Med. 24, 1559–1567 (2018).
[6]Schaumberg, A. J., Rubin, M. A. & Fuchs, T. J. Preprint at https://www.biorxiv.org/content/10.1101/064279v9 (2018).
[7] Chang, P. et al. AJNR Am. J. Neuroradiol. 39, 1201–1207 (2018).
[8] He, K., Zhang, X., Ren, S. & Sun, J. In Proc. IEEE Conference on Computer Vision and Pattern Recognition 770–778 (2016).
[9] Rahman, R., Asombang, A. W. & Ibdah, J. A. World J. Gastroenterol. 20, 4483–4490 (2014).
本文作者 | 代丝雨
以上是关于《自然·医学》重磅:人工智能牛大了!深度学习算法竟可直接从病理切片识别基因组不稳定,或可指导免疫治疗 | 科学大发现的主要内容,如果未能解决你的问题,请参考以下文章
重磅丨谷歌是在炒作么?大牛详解神经网络算法为什么不适合自然语言处理