CT的未来:高速低剂量深度学习多能量
Posted 医学影像服务中心
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了CT的未来:高速低剂量深度学习多能量相关的知识,希望对你有一定的参考价值。
让学习成为一种习惯!
医学影像服务中心拥有500病例征象+讲座
原创: 赵喜同学 XI区
计算机断层扫描(Computed Tomography,CT)的出现已经彻底改变了放射学,而这场革命仍在继续。现代CT系统从单纯的头部扫描仪开始,如今可以在几秒钟内完成各向同性分辨率的全身检查、全器官灌注和高时间分辨率的心脏CT成像。
近日,Investigative Radiology(IF:6.091)在线发表了一篇文章,介绍了CT技术的最新进展,作者在2015年也就CT技术进展进行过综述,在新发表的文章中也涉及到部分内容,我们今天就一块来了解一下。
排的竞争减慢
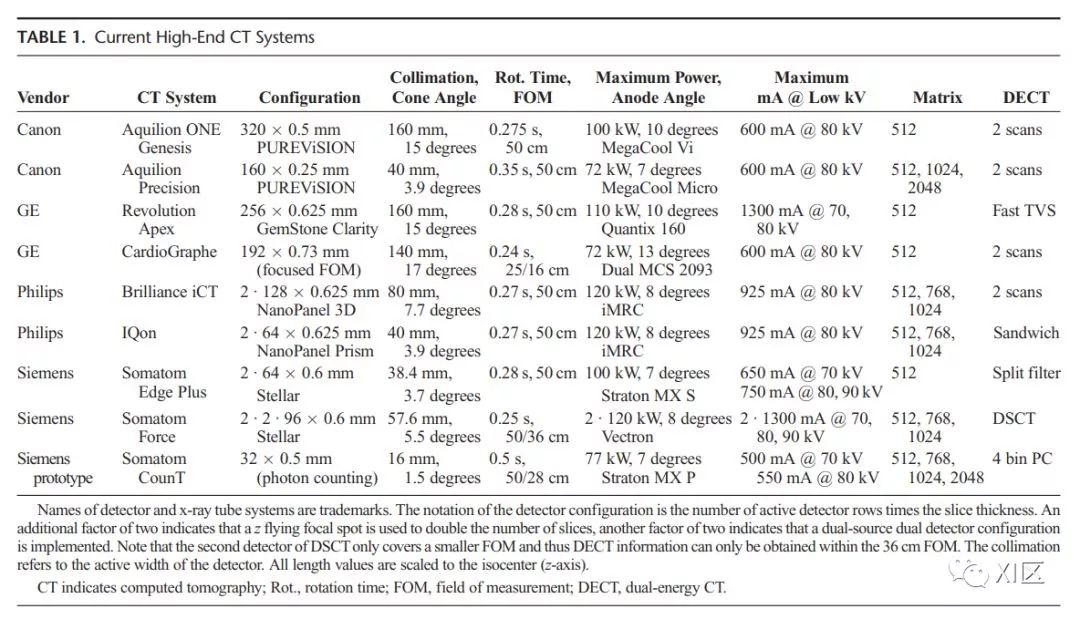
今天的高端CT系统在Z轴方向上有192到320个探测器排列,最大探测器宽度在等中心位置(表1)为16cm。
16cm的探测器宽度是不动床静态或动态全器官成像(大脑、心脏等)的优势与散射增加、锥束伪影、足跟效应的缺点以及因大锥角而在空间分辨率和图像噪声之间权衡而产生的折衷方案。
如果16cm的探测器全部使用,主要采用序列扫描模式。东芝推出了第一个采用这种探测器阵列的系统(Aquilion One,2007),通用电气也沿着这条道路,在2013年RSNA推出了16cm的探测器的CT系统(Revolution CT)。
2018年RSNA上公布了一个专用的心脏CT系统(CardioGraph; GE Healthcare/Arineta),其在X-Y轴方向上最大视野为25或16cm,探测器宽度为14cm。与双源CT系统(西门子)相比,该系统也配备了两个球管,但两个球管在X-Y平面上位置相同,并使用一个探测器阵列接收信号(图1)。这种“立体CT”技术旨在减少宽探测器的锥束伪影,并寻求更好地利用所施加的X射线剂量。
所有探测器宽度大于8厘米的CT系统都有一个共同点,即它们仅以序列模式使用整个探测器宽度。如果扫描范围超过探测器宽度,则应用螺旋扫描模式,该模式仅使用中央部分的探测器以最大程度地减小过度照射(overbeaming)(例如,对于Aquilion One系统,螺旋扫描使用64x0.5 mm)。
因为心脏CTA现在可以在大多数高端CT系统的一次心跳内完成,所以更多探测器排列的主要驱动力之一已经消失。离心力在物理上限制了机架更快旋转的速度,尽管GE在2014年承诺将旋转时间缩短至0.2s,但这尚未实现。目前,CT的最快转速是0.24s (CardioGraph),它的源轴距(source-axis distance,是指探球管到机架旋转轴的距离)仅为45cm,因此对于给定的离心力可以更快地旋转,该系统的缺点是机架孔径较小,视野有限,限制了其在心脏和中心血管的应用。
Lell MM, Wildberger JE, Alkadhi H, et al. Evolution in computed tomography: the battle for speed and dose. Invest Radiol. 2015;50:629–644.
Lell MM, Kachelrieß M. Recent and UpcomingTechnological Developments in Computed Tomography: High Speed, Low Dose, DeepLearning, Multienergy. Invest Radiol. 2019 Sep 16.
球管技术
先前详细讨论过的X射线管设计和技术原理仍然有效:为了更快地扫描,更重要的是,在应用低千伏扫描协议时,减少X射线照射,需要更高的X射线管功率(表1)。
要在足够短的扫描时间内使重症患者的胸部、腹部或主动脉CTA进行CT扫描,以使患者舒适地屏住呼吸,就需要更快的转速和移床速度,因此需要更高的球管输出。典型的最大球管功率约为100 kW或更高。对于双源CT系统,这些值将翻倍。由于在过去的几十年中扫描时间显着减少,因此最新一代的X射线球管(Vectron,Siemens)已针对非常短的曝光时间内的高曝光水平进行了优化。不同供应商对比,可以发现最大球管功率的显著不同。
更高的管功率并不意味着更高的患者剂量,相反,它可能是显着降低患者剂量的措施的基础。
已经引入了专用的前置滤波器来修饰光谱形状,并有选择地从光束中去除低能光子,否则这些光子将被患者吸收而不是到达探测器。用100kV和Sn滤过扫描胸部,使胸部CT在常规胸片(有效剂量<0.2mSv)的曝光水平下成为可能,非常适合未来的筛查项目。
如在一些西门子CT中使用的0.4mm的Sn过滤器,可以吸收所有发射光子的大约90%,因此球管输出的管电流需要很高,以在探测器端产生适当的信号(关于能谱纯化技术的原理及更多内容请参见:)。
需要高管电流输出的另一个原因是,不仅在小体型患者中,而且在整个患者队列中,包括较大的高体重指数患者,也需要使用低管电压扫描协议进行快速扫描。
在许多应用中,在低管电压下扫描可增加碘对比度,并允许减少对比剂用量。因此,选择低管电压是减少X射线辐射和对比剂用量的有力工具。100kV已经成为CT扫描仪上的新成像标准,它提供了过去120kV的足够的管电流输出。
几年前,西门子开始提供从70到150kV的10kV级管电压选择,但与此同时,其他CT供应商至少针对低kV值采用了这一特性。
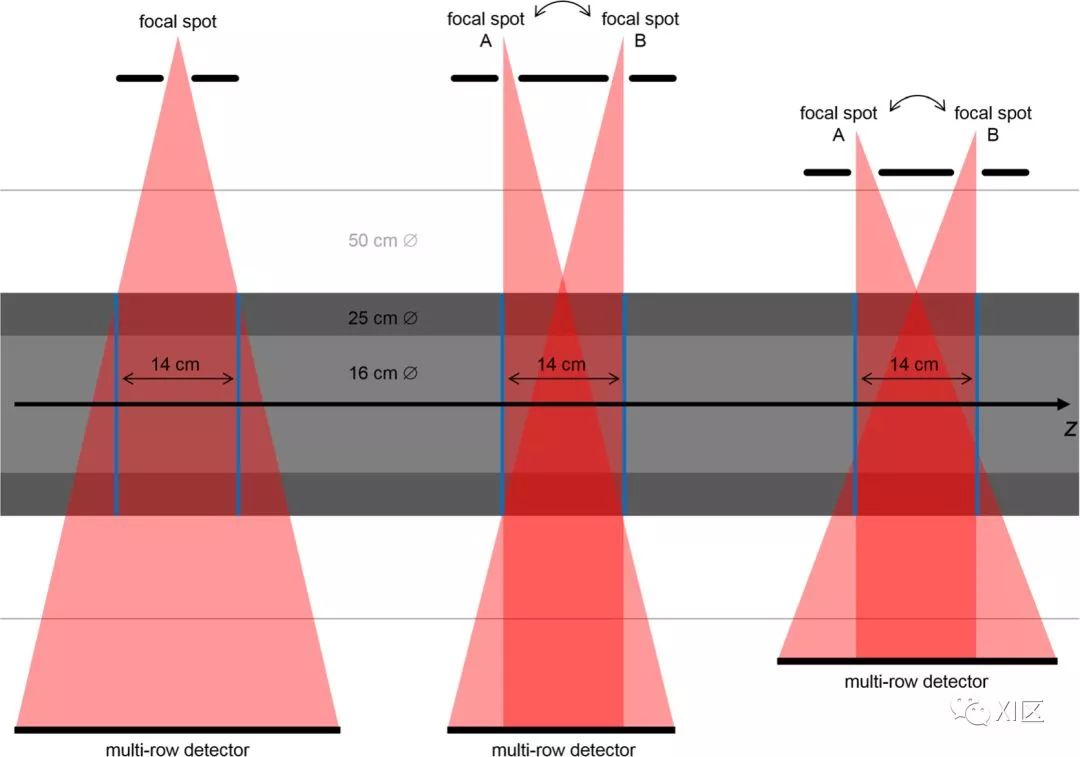
X射线球管的输出也受系统锥角的影响,锥角与探测器排数有关。
如图2所示,X射线球管的阳极角必须随着CT系统的锥角而增大。然而,较大的阳极角意味着电子束的消磁作用较小,为了获得相同的空间分辨率,必须在Z轴覆盖范围更宽的系统中使用更窄、进而功率更小的电子束,以避免阳极熔化。然而,较低的X射线功率限制了辐射剂量减少的可能性。
通用电气在2018年RSNA上宣布了一种新的Quantix 160 X射线球管,可在Revolution Apex中使用,即使在大锥角和阳极角情况下为16cm探测器提供在70kV和80kV下的1300mA的管电流。可以预见,在具有较小锥角的下一代X射线球管中,甚至可以期望更高的管电流值。
探测器技术
CT探测器技术的最新发展涉及探测器元件更小的探测器和光子计数探测器原型。
采用传统探测器技术的CT扫描系统使用0.5 mm、0.6 mm或0.625 mm厚的单排探测器宽度和横向类似的像素尺寸(表1)。唯一的例外是佳能新推出的Aquilion Precision,其中超高分辨率(UHR)探测器的像素尺寸为0.25x0.25mm(按等中心位置计算)。较小的隔板确保了仍然可以接受的几何效率。与较小的焦点一起,该系统能够提供更高空间分辨率的CT图像。这项技术不同于西门子推出的UHR模式,后者在探测器阵列前引入了UHR梳状或栅极,以提高空间分辨率。
如果使用来自较小探测器元件的数据在给定分辨率下进行图像重建,则图像噪声会降低。这种效果(图像噪声降低10%-20%)最近在光子计数探测器系统中得到了报道;使用传统探测器材料的佳能系统也有类似的效果。除了较小的探测器元件外,建议使用较高的矩阵(高达1024而不是512)进行图像重建(表1)。
在不久的将来,传统的CT探测器技术,即X射线被间接转换成电信号,可能会被直接转换器所取代。这些直接转换器是基于半导体,直接将X射线光子转换成电流。单个X射线光子产生的信号短到可以在下一个光子到达之前衰减,因此可以对单个光子进行量化。为了避免在第一个光子的信号尚未衰减的情况下进一步到达光子,这种情况称为“堆积”,光子计数探测器的像素通常比传统探测器的像素小,每个信号下的面积与入射X射线光子的能量成正比在将此区域转换为高度之前,在分析之前对电脉冲进行平滑处理,然后与阈值电压进行比较通常2到4个阈值被构建到一个像素中,因此可以分离多达4个能级(或能量箱)。
光子计数探测器应比传统探测器具有多个潜在优势:
由于没有电子噪音,噪声更小
由于统计效应产生的噪声较小(斯旺克系数)
由于统计上的最佳能量箱加权的可能性,噪声更小
如果以较低的空间分辨率重建小像素数据,则噪声较小
像素更小,空间分辨率更高(避免重叠)
光谱信息,通常有2或4个能量箱
减少噪声总是可以与更积极的剂量减少相平衡。由于计数的处理是纯数字的,因此可以根据需要回顾性地使用上述特征。这意味着不再需要特定的高分辨率或双能量协议,因为这些信息可以从原始数据中追溯得出。
在图3中,比较了使用常规探测器阵列的CT系统和具有匹配成像参数的台式光子计数探测器CT对低对比度体模的扫描。

虽然存在许多台式实验,但只有一个带有光子计数探测器的全身CT系统可以用于人体的扫描,目前在全球范围内进行了3处安装(梅奥诊所,罗切斯特,明尼苏达州;NIH临床中心,贝塞斯达,马里兰州;DKFZ,海德堡,德国)。该系统具有双源CT扫描架,该扫描架带有一个常规探测器和一个光子计数探测器,后来使用CdTe传感器材料。
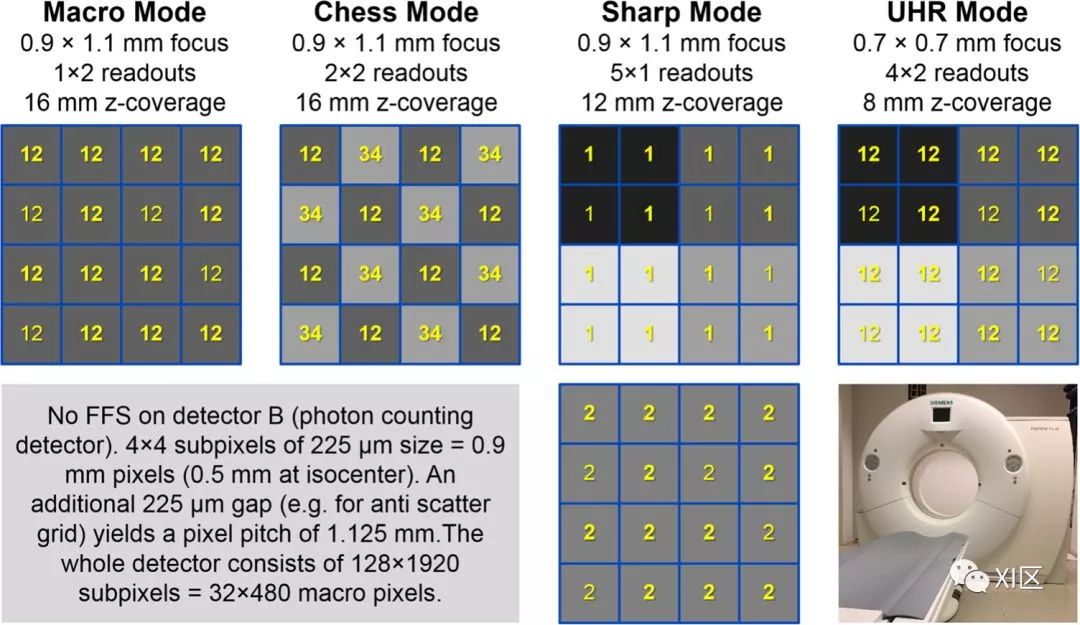
图4 光子计数探测器CT原型系统提供了几种不同的读出模式,它们在空间分辨率和能量箱数量上有所不同。该图显示了一个像素的布局,该像素被分成4乘4个子像素,从中将相同颜色的子像素合并(添加计数),然后再读出。这些子像素中的数字表示能量箱编号。例如,“ 12”表示可以同时读取箱1和箱2。锐利模式是高分辨率和低分辨率像素的组合,因此在此插图中需要2个面板。图为DKFZ安装的CounT系统。
Lell MM, Kachelrieß M. Recent and UpcomingTechnological Developments in Computed Tomography: High Speed, Low Dose, DeepLearning, Multienergy. Invest Radiol. 2019 Sep 16.
它在4种不同的探测器模式下工作(图4),其中锐利和UHR模式是最通用的。然而,由于数据传输速率的限制,这种通用性是以降低原型系统的Z轴覆盖率为代价的。这样的约束或折衷对于原型CT系统是合理的。最终产品的实现肯定需要克服这些限制。鉴于传统CT检测器的高度成熟性,令人印象深刻的是,一项非劣质性研究证明CounT与最新的临床CT系统一样出色。
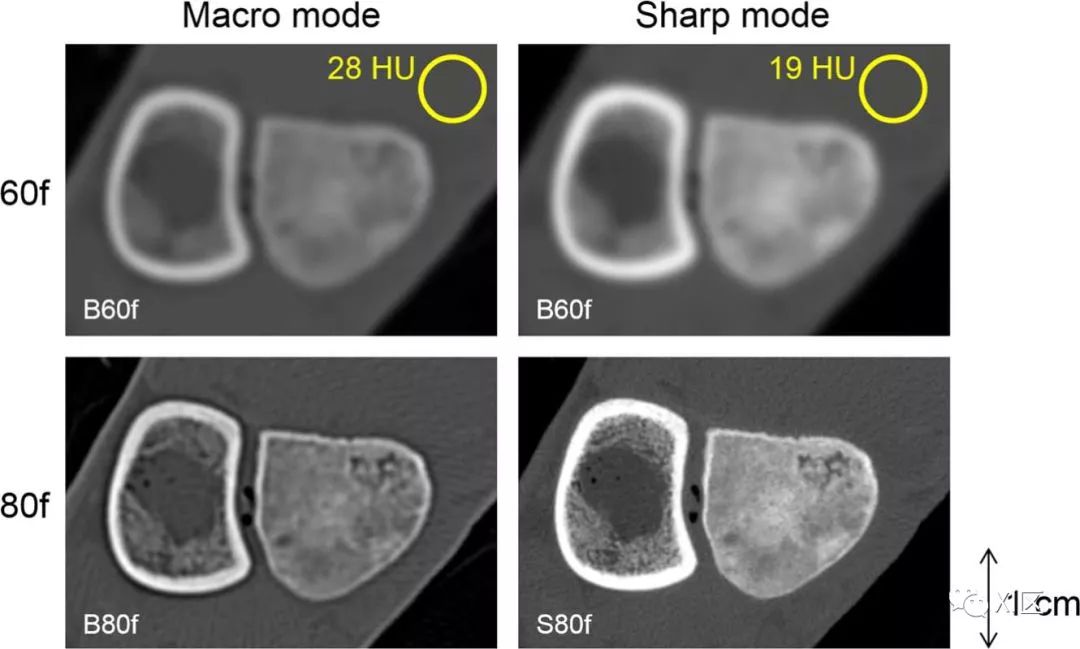
特殊的光子计数检测器模式可以读取宏像素或较小的子像素,从而可以很好地展示较小像素(较大的空间分辨率或较低的噪声)相对较大像素的优势,如图5所示。传统探测器与光子计数探测器CT之间图像分辨率的直接比较如图6所示。
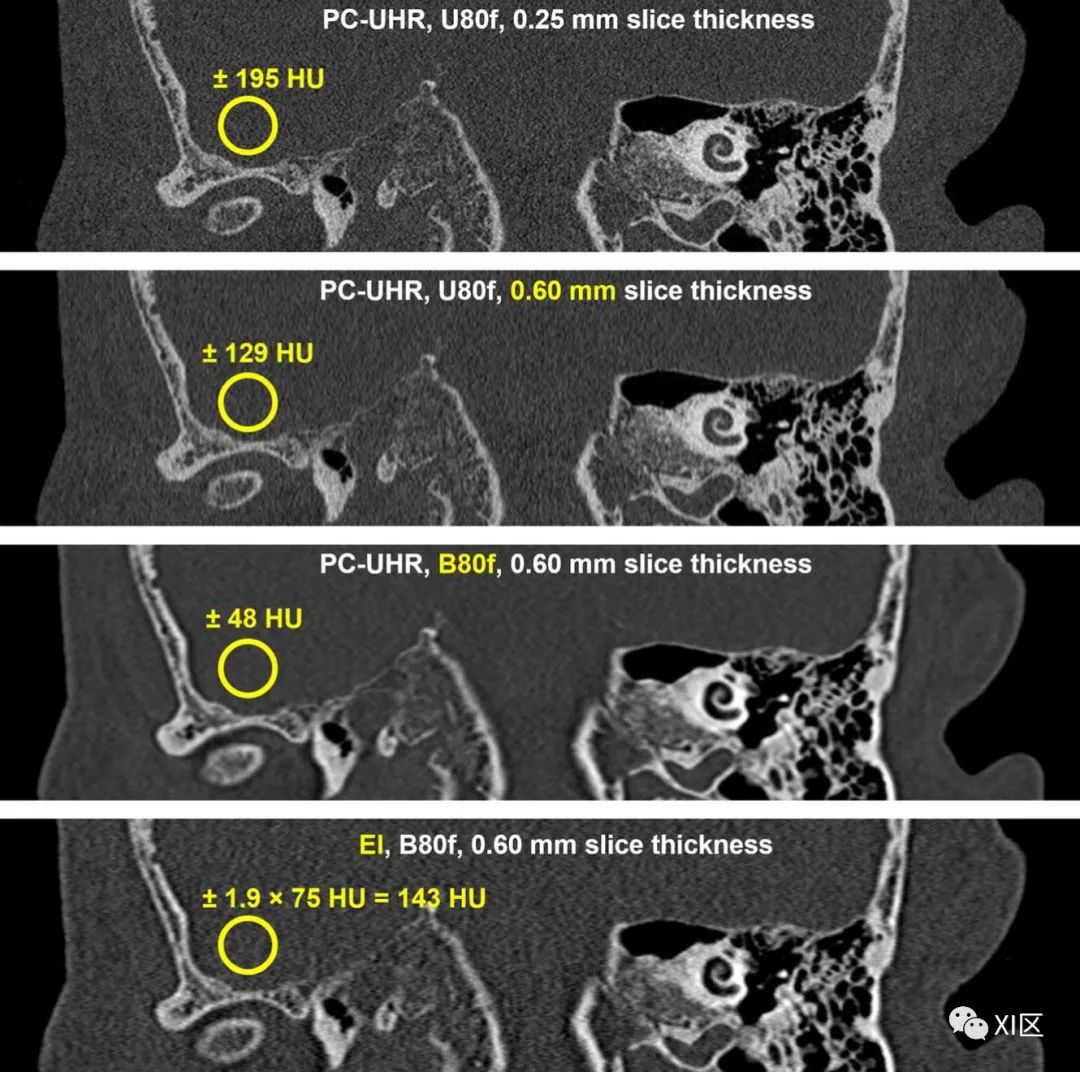
图6 两次头部扫描的冠状位重建(1024矩阵,0.15mm层间距),显示耳蜗,其中包括具有像素噪声值的ROI。上部3幅图像:光子计数探测器扫描(24.2mgy CTDI)重建不同的卷积核和层厚。底部:能量积分探测器扫描(6.8 mGy CTDI)。最后两个图像在x,y和z中具有相同的MTF。由于两次扫描的剂量不匹配,因此像素噪声无法直接比较。在相同剂量下,能量积分扫描的噪声为75 HU,因此比相同空间分辨率下相应光子计数探测器扫描的48 HU高得多。由德国癌症研究中心的Monika Uhrig博士和海德堡大学法医学研究所的Sarah Heinze博士提供。C = 1000 HU,W = 3500 HU。
Lell MM, Kachelrieß M. Recent and UpcomingTechnological Developments in Computed Tomography: High Speed, Low Dose, DeepLearning, Multienergy. Invest Radiol. 2019 Sep 16.
剂量减少技术
管电流调制/自动曝光控制
管电流自适应的技术基础可以追溯到1981年管电流角调制(TCM),该技术可以导致15%到50%的剂量减少,取决于x-y平面的解剖区域。实时TCM计算不仅减少了患者的曝光剂量,还使噪声分布更均匀,从而提高了图像质量。
平面TCM的逻辑发展是纵向的或Z轴的。与考虑平面内不同衰减的角度调制(例如,横向投影与肩部水平的前后投影)类似,纵向TCM旨在均匀化噪声,同时考虑胸部与腹部或骨盆的不同衰减。采用基于原始数据或衰减的实时调制算法,实现了不同的解决方案。
自动曝光控制类似于一组包含(三维)TCM的算法,其目的是在从定位图衍生的一系列患者尺寸上提供预定义的图像质量,对于大体型患者增加CTDIvol,对于小体型患者减少CTDIvol。
因为自动曝光控制算法假设病人处于等中心,所以摆位时患者位置处于孔径中心非常重要(关于自动管电流调制技术的更多内容参见:)。为了优化患者的位置,引入了一种吸顶式三维摄像系统,该系统可以识别患者的位置并相对于机架坐标进行优化。
如果扫描范围超出了定位图的范围,则CT系统可以使用最大或最小的mAs设置,或者介于两者之间(标准mAs设置或最后计算位置的mAs设置)之间的不同行为。目标图像质量的预测也不同,一种方法是使用参考标准患者的设置,而其他方法使用噪声指数。
低千伏扫描
在低电压下扫描会增加对比剂的衰减。随着更强大的X射线球管的实现,低千伏扫描变得实用并日益普及。增大的碘衰减既可以用来减小对比剂的体积,也可以用来减少辐射的暴露(通过更高的对比度来补偿更高的图像噪声),或者两者兼而有之。
自动选择管电压和管电流调制技术,利用病人的衰减信息并考虑计划的检查类型,将这项技术推广到日常应用中。根据检查类型、患者大小和低电压下的管电流,已报告剂量减少10%至30%。
然而,新的高性能X射线球管的可用性,可以在较低的管电压下提供非常高的管电流,将导致更高的剂量减少。对于儿科CT血管造影,已报道头部的剂量减少高达70%,胸部的剂量减少了77%,腹部/盆腔的剂量减少了34%。
对于某些协议,还使用了附加的前置滤波器,以从低kV光谱中去除不需要的低能射线,以使图像质量最优化,并使患者的剂量降至常规X光平片水平。
低剂量CT与噪声抑制
滤波反投影在图像重建中的抑制作用越来越被迭代图像重建技术所取代,它们的设计目的是显著降低图像噪声,并在一定程度上减少图像伪影。
这是通过在重建算法中添加先验知识并改进用于迭代图像重建的正向模型来实现的,该模型可以例如还包括真实的射线轮廓或正确的光子统计信息。
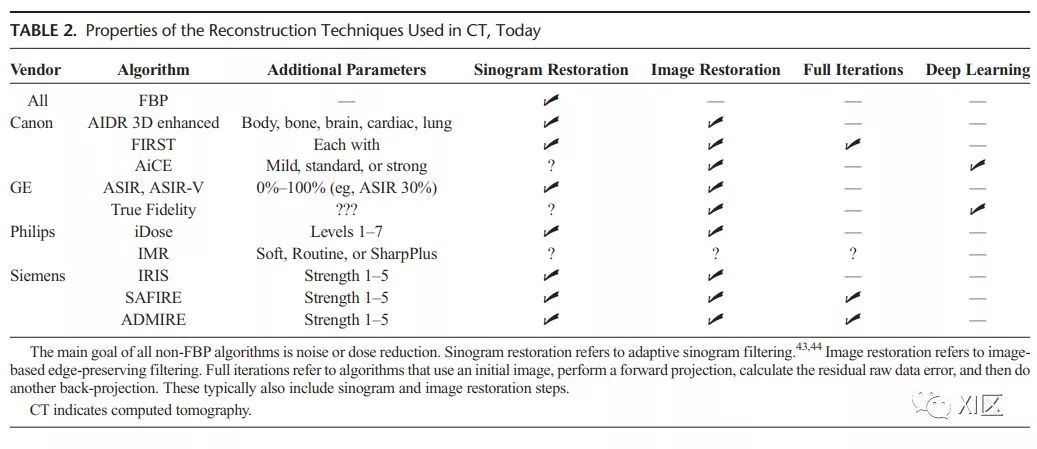
迭代重建可以分为两类:图像后处理类型的算法(AIDR 3D,ASIR,IRIS和iDose)以及能够通过原始数据域进行一次或多次迭代的算法(FIRST, ASIR-V, Veo, SAFIRE, ADMIRE, IMR)。
表2总结了这些算法的一些特性。
Lell MM, Kachelrieß M. Recent and UpcomingTechnological Developments in Computed Tomography: High Speed, Low Dose, DeepLearning, Multienergy. Invest Radiol. 2019 Sep 16.
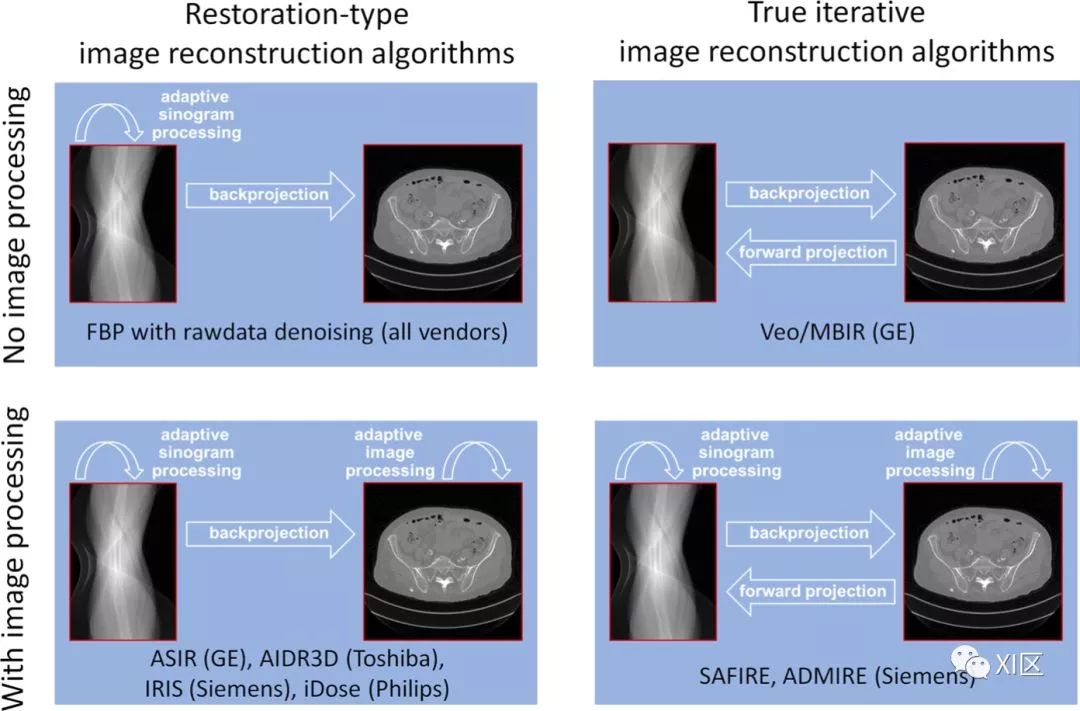
不同迭代重建的分类
Lell MM, Wildberger JE, Alkadhi H, et al. Evolution in computed tomography: the battle for speed and dose. Invest Radiol. 2015;50:629–644.
低剂量(LD)CT协议和迭代重建算法(特别是在原始数据域中迭代的算法)在降低噪声和恢复图像质量方面显示了它们在各种临床环境中的潜力。
以胸部CT为例,由于各种原因,LD技术是一种非常有前途的应用:它是一种相当频繁的检查,对辐射敏感的器官都在扫描范围内,并且存在很大的解剖衰减差异。
超低剂量(ULD)CT的剂量水平与常规胸部X线相当。ULD这个术语没有明确的定义;在本文中,它被定义为小于0.2 mSv的CT检查,大体上是参考了正侧位胸片的剂量水平。
Hu Wang等的研究显示,在淋巴管平滑肌瘤病患者中,胸部CT辐射水平为0.14 mSv(0.10-0.20 mSv)的MBIR提供了与标准剂量CT相似的囊肿定量。在一项对囊性纤维化(CF)患者的研究中,Ernst等人报告了常规(儿童<18岁的平均估计有效剂量,0.52 mSv;成人,1.12 mSv)和ULD(儿童,0.04 mSv;成人,0.05 mSv)胸部CT的Bhalla评分相似。但也存在一定的局限性,文章所示的ULD病例图像质量明显低于常规CT。作者认为,带MBIR的ULD-CT方案只应用于无恶化的患者随访。Villanueva-Meyer等人证明,小儿ULD胸部CT可能足以排除呼吸道异物,但对评估实质性肺病的价值不太理想。
Nagatani等人在83名患者队列研究中评估了ULD胸部CT对结节的检测能力,这些患者在一次就诊中连续接受了3次不同剂量设置(120kV,0.35s/rot,240[常规剂量;参考值]/120[LD]/20[ULD]mA;ADIR3D)的CT扫描。他们的ULD方案的平均有效剂量比我们前面的定义略高(0.29 mSv)。他们可以证明,ULD和LD在评估大于3mm的实性结节和大于8mm的磨玻璃结节时的表现相似。在类似的情况下,Katsura等人没有发现LD-ASIR和ultra-LD MBIR在毛玻璃不透明度、部分固体或固体结节的总体敏感性方面存在显著差异。Kim 等报告了100%采用LD方案(平均有效剂量,1.06±0.11 mSv)、96%采用ULD-1方案(平均有效剂量,0.44±0.05 mSv)和88%采用ULD-2方案(平均有效剂量,0.31±0.03 mSv)的检查的整体图像质量分级诊断。所有具有非诊断质量图像的患者的体重指数均大于25。需要进一步的剂量发现研究,以确定在不影响肺癌筛查项目的各种不同CT系统的病变检测的情况下,最低辐射暴露的方案。
最近,一系列新的基于深度学习的图像重建算法被公布(表2)。由于这些算法不仅可以被视为剂量减少方法,还可以被视为提高图像质量和减少伪影的方法,因此将在下一节讨论它们。
基于深度学习的图像还原/重建
随着神经网络,尤其是卷积神经网络(CNN)的普遍成功,深度学习已迅速进入医学成像领域。卷积层的内在属性利用了图像数据中存在的局部相关性。几个(线性)卷积层和非线性层的组合实质上使它们成为可以普遍近似任何函数的多参数函数。CNN具有可以将有噪声的CT数据映射到降噪数据的功能。它也可以是将带有伪影的CT数据映射到伪影减少的CT数据的功能。这种通用逼近函数的开放参数数量达到数百万或数十亿,需要使用大量数据进行训练。
在训练期间,这些网络学习CT图像的典型特征,并学会避免在此类特征边界上进行平滑处理以避免空间分辨率损失。AI网络学习到的各种功能有望使它们比使用手工先验(总变化最小化,边缘保留先验等)的迭代恢复或重建技术强大得多。训练网络以降低噪声的最简单方法是提供LD图像作为输入,提供同一患者的高剂量图像作为输出。可以通过在原始数据(虚拟数据)中添加噪声来模拟LD图像。
另一种方法是无监督网络,不需要匹配的数据对(输入-输出)进行训练。这些所谓的生成对抗网络(GAN)和条件GAN(cGAN)是当今最流行的无监督方法。简而言之,对生成器进行训练以从LD图像生成高剂量图像,而对鉴别器进行训练以在虚拟高剂量图像和实际高剂量图像之间进行区分(例如,来自不同扫描或不同的患者)。使用GAN方法,训练不一定需要成对的训练数据即可实现有效的降噪。
关于商业实现只有很少的细节。佳能的AiCE方法似乎在以FBP作为输入的LD图像和以佳能迭代重建算法作为输出的高剂量图像上进行训练(图7)。
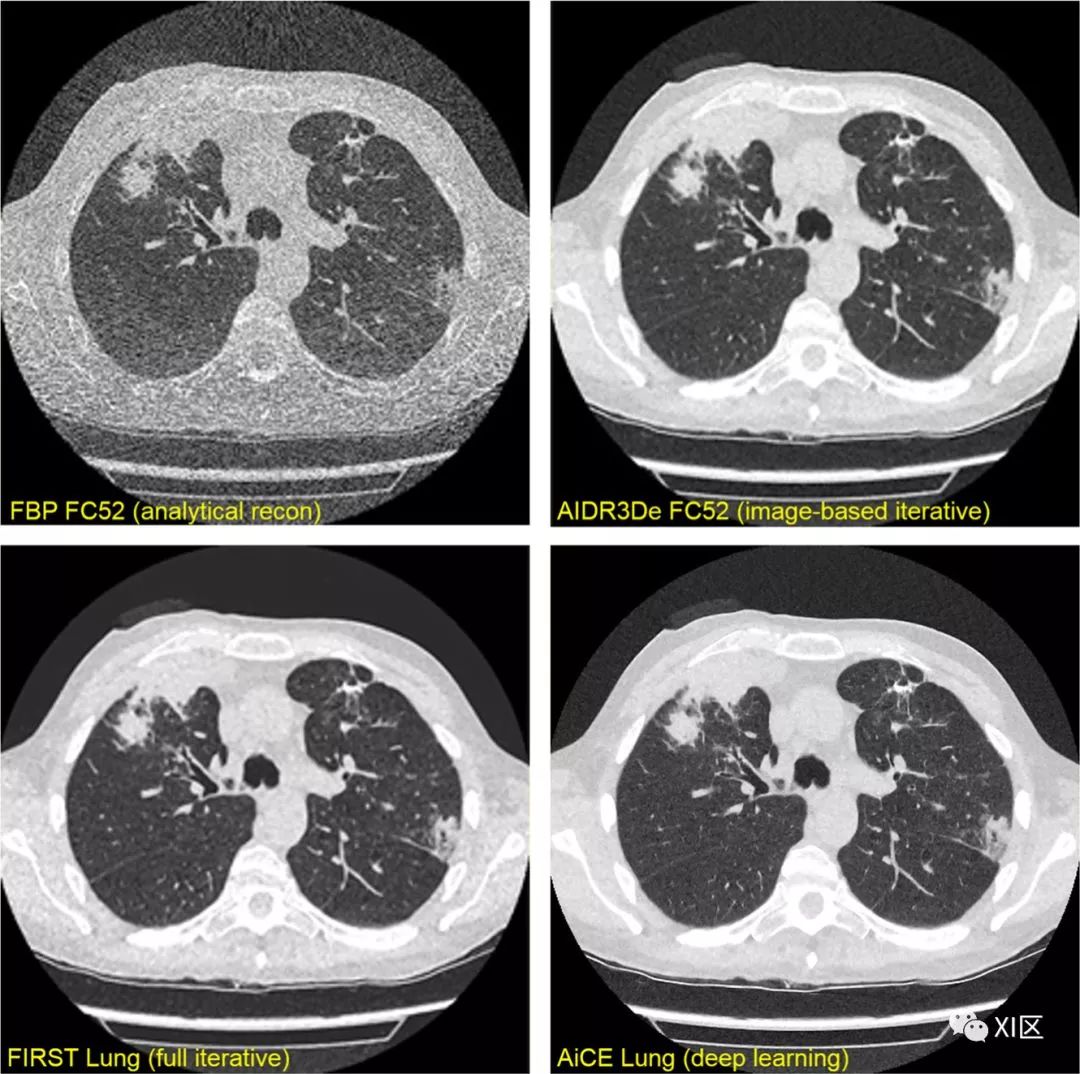
目前只能推测GE算法的真实逼真度:Ziabari等人和在2018年底的会议上发表的GE集团的其他类似参考文献讨论了一种神经网络,该神经网络将FBP图像转换为使用GE相当慢的迭代算法Veo(也称为MBIR)重建的图像。为了提高收敛性,深度学习算法输出残余Veo减去FBP,然后将其添加到FBP图像。讨论了算法的二维,2.5维和三维变化,其中2.5维版本是计算速度和图像质量之间的最佳折衷方案。基本上,佳能和GE深度学习算法都是图像恢复,而不是图像重建,因为它们是将有噪声的图像转换为降噪的图像。
这种基于深度学习的图像重建算法在临床实践中的影响仍然有待证明。
图像重建中的其他深度学习应用
除降噪外,还可以实现深度学习以减少伪影。
基于卷积神经网络的金属伪影减少(MAR)方法已被提出,但尚未证明这些算法优于传统算法,如NMAR和变量。取而代之的是,CNN的一种方法建议通过深度学习来组合多个MAR算法的图像。
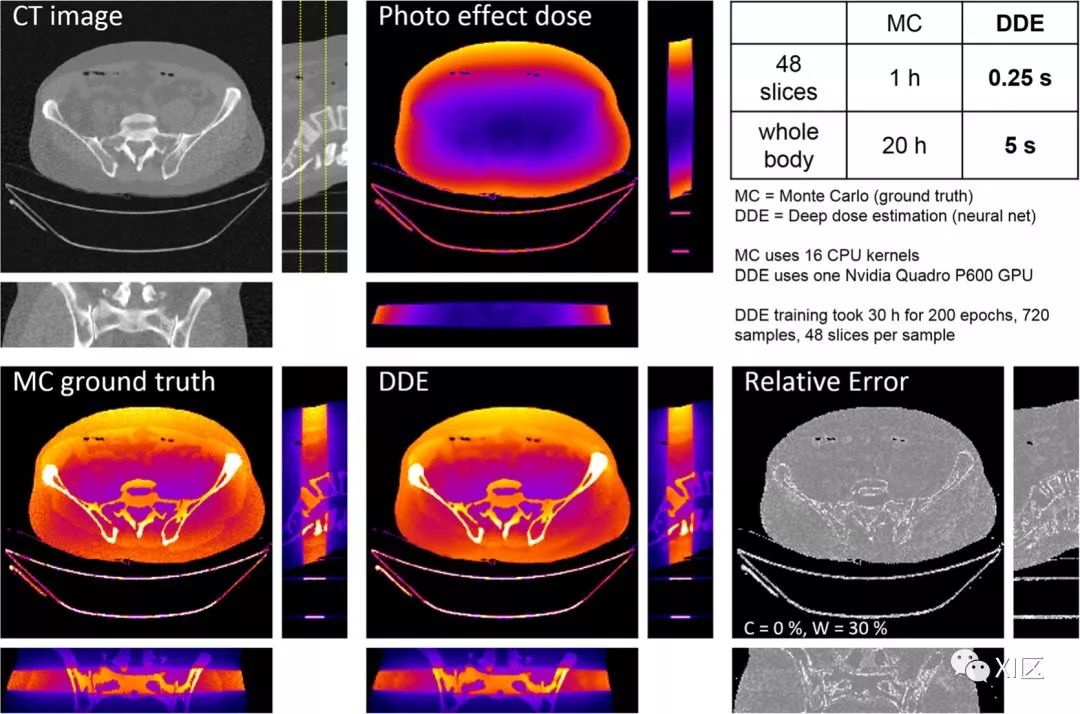
深度学习也可用于散布估计。深度散射估计是基于蒙特卡罗散射估计的一种高效计算替代方法;尽管参考标准需要几分钟或几小时来计算X射线散射,但是深度散射估计的执行时间不到一秒钟,并且也适用于严重的数据截断的情况。
这同样适用于估计剂量分布,该剂量分布可用于更准确地计算剂量和风险,还可用于设计更有效的剂量扫描方案。
蒙特卡洛需要几个小时,而深度剂量估算只需几秒钟即可完成(图8)。
运动补偿
大多数成像方式都会受到患者运动的影响。虽然更宽的探测器阵列、更高的机架旋转速度和双源技术大大缩短了采集时间,但单源系统的时间分辨率约为125ms,双源系统的时间分辨率约为63ms,这可能仍然不够快,无法完全冻结心脏运动。在50mm/s及以上的速度时,残余运动模糊可能出现在不可忽略的心脏CT检查中。
获取目标相位之外的图像,例如,目标相位前后10%的图像允许估计心脏运动,一旦运动已知,就可以执行解释该运动的重建。Snapshot freeze(GE Healthcare)就是这类算法的一个例子。利用此类数据冗余(超过180度的数据)的其他方法在原始数据域中运行。
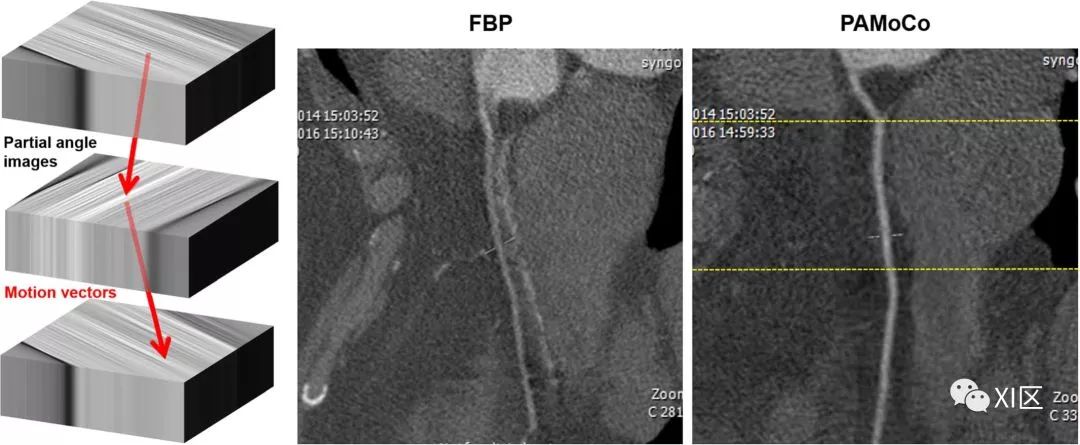
如果没有其他可用数据,并且只能重构单个图像,则可以分析伪影来估计运动。最大化局部清晰度的一种解决方案是最小化熵。该算法通过局部选择运动方向和速度,获得熵最小的图像,并可能与阳性约束条件相结合。MAM和PAMoCo是这些方法算法的示例。
图9显示了PAMoCo算法的示例:重构了部分角度图像(图示中为3个,在实现中通常大于10个),并且在这些图像被组合之前(通过求和),计算运动向量,当根据这些向量在组合之前移动图像时,产生最小熵图像。
双能量CT
双源系统的引入使双能CT(DECT)这一古老的概念焕然一新。同时,DECT由所有主要CT制造商提供DECT在临床上有不同的实现方式:双源、kV快速切换、双层探测器、两次扫描和TBDE技术。
所有的方法都有其优点和缺点:双源系统能很好地分离光谱和mAs调制,这种方法视野有限,时间偏移最小,散射校正更复杂,最后但同样重要的是需要第二个X射线球管,这增加了系统的造价。
飞利浦的方法是使用单球管但2个探测器层,顶部是基于钇的石榴石闪烁体,底部是氧化钆闪烁体。这是方法理论上可以对DE后处理进行追溯,并且在两个数据集之间没有任何时间延迟。在实际应用中,更高的管电压有利于改善光谱分离。与其他DECT实现方法相比,追溯使用DE的选项具有很大的优势。但是,与其他实现方法相比,双层技术的代价是光谱分离的减少。
光子计数探测器可以在单个探测器层中分辨出2个或更多的能量窗,因此本质上适合于双能或多能CT应用。它们还受益于回顾性方面,因此允许按需使用光谱信息,而不管扫描协议如何,前提是以最佳方式设置管电压和前置滤线器即可。
DECT的各种临床应用已经在体内外得到了发展和评估,其中虚拟平扫成像、自动骨去除、肾结石成分分类、痛风成像、MAR以及心肺应用最为丰富。虚拟单能成像(VMI)可用于减少骨科硬件中的金属伪影,但在双侧假体植入的患者中,VMI被认为不如iMAR算法。VMI的另一个实现是优化CTA中的碘增强,可以用来减少对比剂的体积,用次优的血管增强恢复CTA,或者从门静脉期采集中创建虚拟的动脉期图像。因此,VMI有可能减少辐射或对比剂的暴露(图10)。
结论
尽管近年来,速度和排的竞争已经放缓,但CT的魅力丝毫没有减弱。新的探测器概念将提供更高的平面内分辨率,并且能够在与传统平片相当的剂量水平下进行CT扫描,为筛选程序开辟了新的视野。 用于各种任务(图像重建,预处理,注释甚至分析)的机器学习算法正在激增,并将极大地改变我们的日常工作。
本文编译自:Lell MM, Kachelrieß M. Recent and UpcomingTechnological Developments in Computed Tomography: High Speed, Low Dose, DeepLearning, Multienergy. Invest Radiol. 2019 Sep 16. 文章所述内容为原作者观点,仅用于专业人士交流目的,不作为商业用途。
2019年11月11日
考试培训
1、
2、
3、
4、
关注【医学影像服务中心】,有你想要的精彩!小编微信:yxyxfwzx
以上是关于CT的未来:高速低剂量深度学习多能量的主要内容,如果未能解决你的问题,请参考以下文章
清华大学刘洋--基于深度学习的机器翻译--- 低资源/多模态
Diffusion Models/Score-based Generative Models背后的深度学习原理:基于能量模型和受限玻尔兹曼机