珠联璧合 | mCRPC联合治疗的研究进展
Posted 医学界肿瘤频道
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了珠联璧合 | mCRPC联合治疗的研究进展相关的知识,希望对你有一定的参考价值。
目前多种新型药物以及联合治疗方案均在探索中,如何选择最佳的治疗方案?如何合理的组合?董柏君教授带您了解最新研究进展。
2020年2月13-15日,美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(ASCO-GU)在美国旧金山隆重召开。转移性去势抵抗性前列腺癌(mCRPC)是前列腺癌疾病进展的终末期阶段,患者往往预后较差。目前多种新型药物以及联合治疗方案均在探索中,如何选择?如何组合?这是mCRPC治疗中所面临的挑战。本文中,上海交通大学附属仁济医院泌尿外科董柏君教授将为我们盘点2020 ASCO-GU mCRPC联合治疗的研究进展。
这是一项回顾性研究,纳入2013-2016年期间8家医院患有骨转移CRPC且一线接受阿比特龙治疗的患者,根据是否同时使用骨吸收抑制剂(唑来膦酸或地舒单抗)对患者进行分组,根据CHARRTED研究中高/低肿瘤负荷标准对患者进行分层。研究终点包括OS和ttSRE(从开始阿比特龙治疗至出现第一次骨相关事件的时间)。
纳入的754名患者,其中529名(71%)仅接受阿比特龙治疗,216名(29%)接受阿比特龙联合骨吸收抑制剂,中位随访时间23.5个月。
研究结果显示,接受阿比特龙联合骨吸收抑制剂的患者具有更长的OS,相较于单独阿比特龙治疗降低35%的死亡风险(31.8个月 vs 23个月,HR=0.65;95%CI 0.54-0.79;P<0.0001);高肿瘤负荷亚组具有更显著的OS获益(33.6个月 vs 19.7个月,HR=0.51;95%CI 0.38-0.68;P0.0001),低肿瘤负荷亚组患者OS没有从联合治疗中获益(31.8 vs 33个月,HR=0.93;95%CI 0.68-1.26;P=0.622)。
接受阿比特龙联合骨吸收抑制剂的患者具有更短的ttSRE(32.4个月 vs 42.7个月,HR=1.27;95%CI 1.0-1.60;P=0.0439)。值得注意的是,接受联合治疗的低肿瘤负荷亚组患者出现第一次骨相关事件的风险超过整组人群的2倍(25.2个月 vs NR,HR=2.29;95%CI 1.57-3.35;P<0.0001)。
这项研究显示阿比特龙联合骨吸收抑制剂一线治疗骨转移CRPC患者可延长OS,尤其高肿瘤负荷患者OS获益更显著。但联合治疗组的ttSRE更短,这与低肿瘤负荷患者采用联合治疗出现骨相关事件的风险更高。这些数据提示阿比特龙联合骨吸收抑制剂对于高/低肿瘤负荷的患者可能具有不同的临床结局影响[1]。
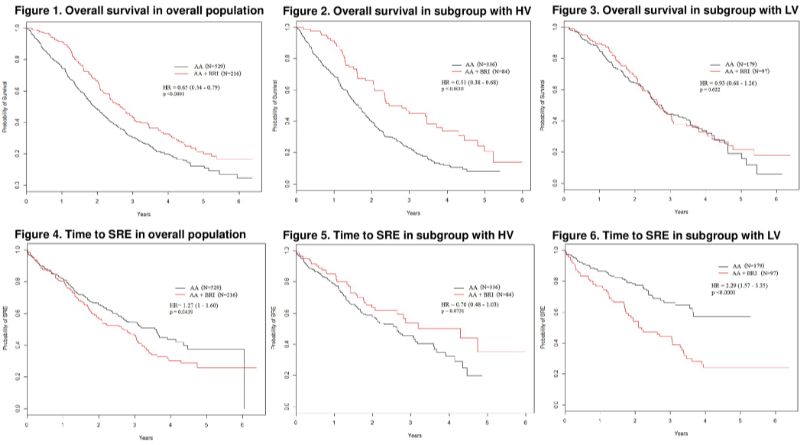
图1 总人群/高肿瘤负荷亚组/低肿瘤负荷亚组的OS和ttSRE
这是一项多中心随机II期研究,患者按随机1:1接受阿比特龙+泼尼松治疗,失败后交叉使用卡巴他赛(第1组)或阿比特龙+泼尼松+卡巴他赛治疗(第2组)。主要研究终点为rPFS(从随机化至影像学进展或死亡的时间,以先发生者为准)。试验设计如下图:
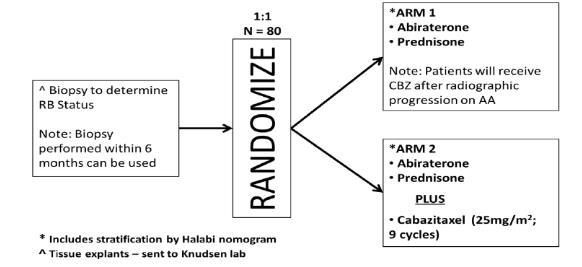
图2 阿比特龙联合卡巴他赛 vs 阿比特龙研究设计
2014年10月至2019年3月期间,93名患者参加此项试验,其中81名患者被随机分配:第1组42名,第2组39名。中位年龄为68岁,ECOG体能状态为0或1,研究终点如下:
表1 各研究终点数据
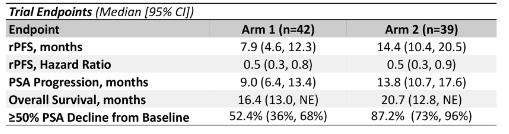
结果显示,阿比特龙联合卡巴他赛(第2组)相较于第1组提高了rPFS(14.4个月 vs 7.9个月)以及至前列腺特异性抗原(PSA)进展时间、OS和PSA应答率。此次分析结果提示,未化疗mCRPC患者接受阿比特龙联合卡巴他赛治疗具有可接受的毒性,支持未来进一步探索阿比特龙+卡巴他赛联合治疗在mCRPC中的应用[2]。
有研究提示PARP抑制剂与雄激素受体靶向治疗(ART)可能会诱导mCRPC患者治疗的敏感性,对于DNA修复基因缺陷(DRD)的mCRPC患者可以通过合成致死作用增加PARP抑制剂的敏感性,因而PARP抑制剂与ART的联合应用成为近期mCRPC治疗领域的研究热点。
BEDIVERE 1b期研究初步探寻了Niraparib联合阿比特龙或阿帕他胺在mCRPC患者中的安全性及药代动力学,根据不良事件发生情况及药物间的相互作用,Niraparib 200mg+阿比特龙+泼尼松作为II期研究推荐给药剂量,在推荐剂量下,该方案耐受性良好[3]。
基于BEDIVERE研究结果,进行中的MAGNITUDE 3期研究将进一步探寻Niraparib+阿比特龙+泼尼松方案的疗效,今年ASCO-GU会议上也对MAGNITUDE研究设计进行公布。该研究入组的患者均为确诊mCRPC的患者,排除了既往接受过PARP抑制剂治疗及mCRPC阶段接受过恩扎卢胺或化疗的患者,按照DRD检测结果进行分组。分组情况如下图所示:
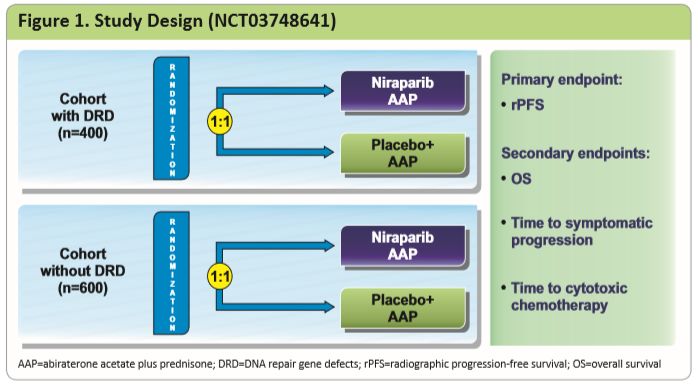 图3 MAGNITUDE研究设计
图3 MAGNITUDE研究设计
研究的主要终点为rPFS,次要终点为OS、至症状进展的时间及至细胞毒性化疗的时间[4]。
该研究目前正在进行中,第一例患者于2019年2月入组。研究结果值得期待。
KEYNOTE-365为一项开放标签的探索帕博利珠单抗联合其他药物治疗mCRPC患者的1b/2期临床研究,分为四个研究队列,探索帕博利珠单抗联合:A.奥拉帕利;B.多西他赛;C.恩扎卢胺;D.阿比特龙。今年ASCO-GU更新了队列A、B、C的研究结果。
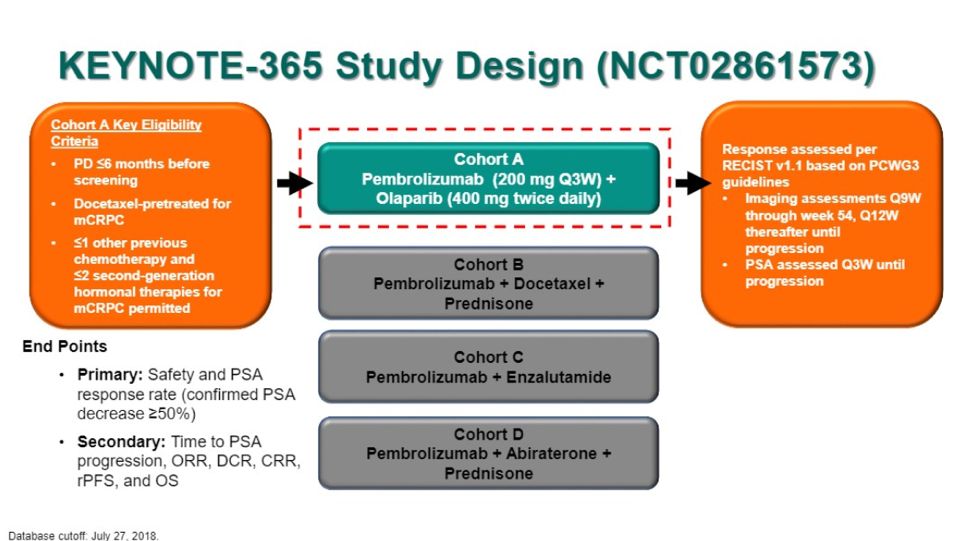
图4 KEYNOTE-365研究设计
队列A(帕博利珠单抗+奥拉帕利)
纳入既往接受过多西他赛治疗,可能接受过1种其他化疗、≤2种新型内分泌治疗,分子水平未经选择的mCRPC患者。患者接受帕博利珠单抗200mg IV Q3W+奥拉帕利400mg PO BID治疗。
研究结果显示:确认的PSA应答率在总人群中为8.5%,包括RECIST-可测量疾病患者中的10.6%和RECIST不可测量疾病患者中的5.7%。总人群中,中位rPFS是4.3个月,中位OS是14.4个月。帕博利珠单抗联合奥拉帕利持续显示出在先前接受过多西他赛和新型内分泌治疗、分子水平未经选择的mCRPC患者中的抗肿瘤活性,未来将会进一步评估与联合治疗应答相关的肿瘤标志物[5]。
队列B(帕博利珠单抗+多西他赛)
纳入既往接受≥4周阿比特龙或恩扎卢胺治疗失败或进展为不耐受的未化疗mCRPC患者。患者接受帕博利珠单抗200mg IV +多西他赛75mg/m2 IV Q3W+泼尼松5mg BID治疗。研究结果显示:PSA应答率为28%,客观缓解率(ORR) 18%,中位OS 20.4个月。帕博利珠单抗联合多西他赛显示出在新型内分泌治疗后失败的mCRPC患者中的抗肿瘤活性,这一组合将会进一步在3期研究中(KEYNOTE-921)进行评估[6]。
队列C(帕博利珠单抗+恩扎卢胺)
纳入既往接受≥4周阿比特龙治疗失败或进展为不耐受的未化疗mCRPC患者。患者接受帕博利珠单抗200mg IV Q3W+恩扎卢胺160mg PO QD治疗,研究结果显示:PSA应答率为22%,ORR 12%,中位OS 20.4个月。帕博利珠单抗联合恩扎卢胺显示出在阿比特龙失败后的mCRPC患者中的抗肿瘤活性。[7]
来自OHSU骑士癌症研究所的Nicole Graff博士在2020 ASCO GU会上对KEYNOTE-199队列4、5的结果进行口头汇报。KEYNOTE-199是一项开发标签、多队列的2期研究,试验设计如下图:
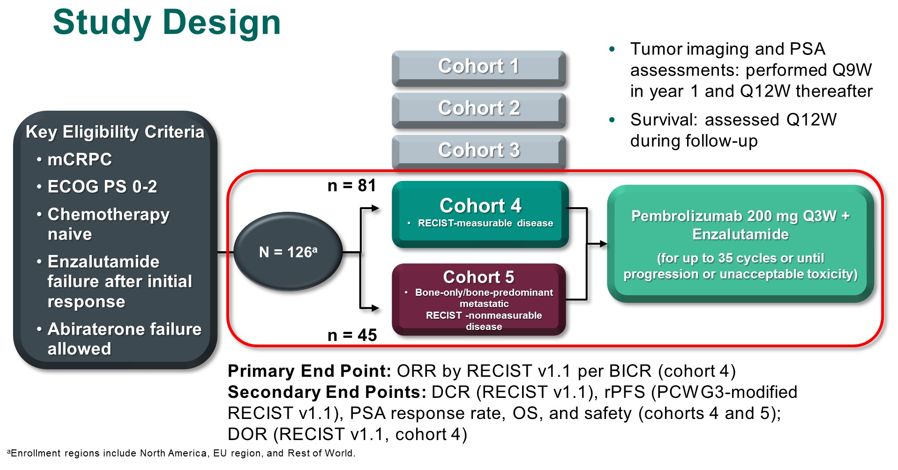
图5 KEYNOTE-199研究设计
队列4(RECIST-可测量疾病)和队列5(骨转移为主,RECIST-不可测疾病)由恩扎卢胺治疗后进展的未化疗mCRPC患者组成,接受帕博利珠单抗200mg Q3W联合恩扎卢胺治疗。主要研究终点是由盲态独立中心审核(BICR)根据 RECIST 1.1评估的总体缓解率(ORR)(队列4)。次要研究终点是疾病控制率(DCR)、PSA缓解率(PSA下降≥50%)、rPFS、OS和安全性(队列4和5);缓解持续时间(DOR)(队列4)。
Nicole Graff博士随后强调了这项研究的结果,在126名患者中(队列4,n=81;队列5,n=45),107名患者停止治疗,主要原因是疾病进展。队列4的中位随访时间是15.3个月,队列5的中位随访时间是19.1个月。
队列4中ORR是12%,DCR是51%,53%的患者经历了目标病灶的减小,24%的患者经历了≥30%的减小。队列5中DCR是51%。队列4的中位缓解持续时间是6.3个月,60%患者的持久缓解大于6个月。
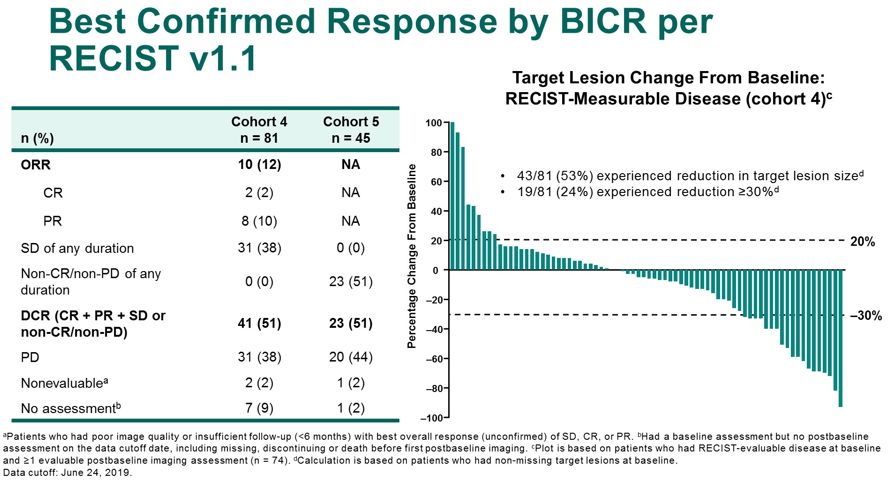 图6 最佳确认缓解率
图6 最佳确认缓解率
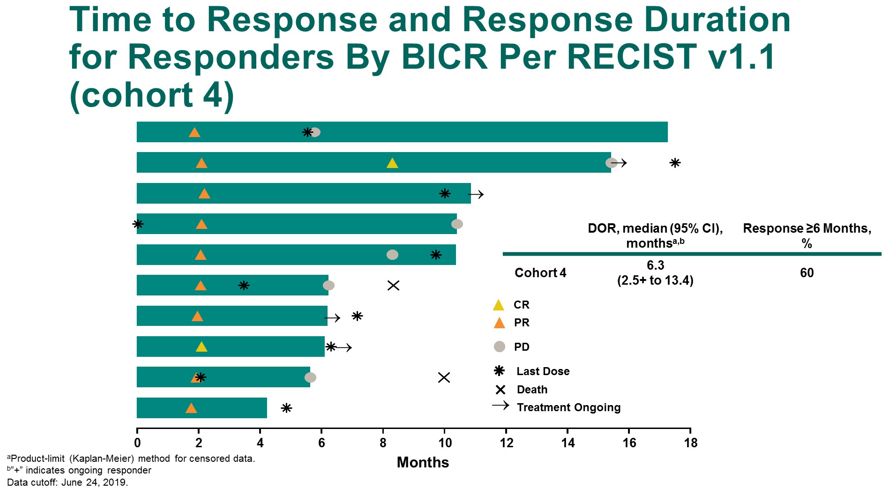 图7 缓解持续时间
图7 缓解持续时间
相较于基线PSA出现下降的患者比例有40%,其中14%的患者PSA下降≥50%。中位rPFS在队列4和队列5中分别为4.2个月和4.4个月,队列5的中位OS为18.8个月。
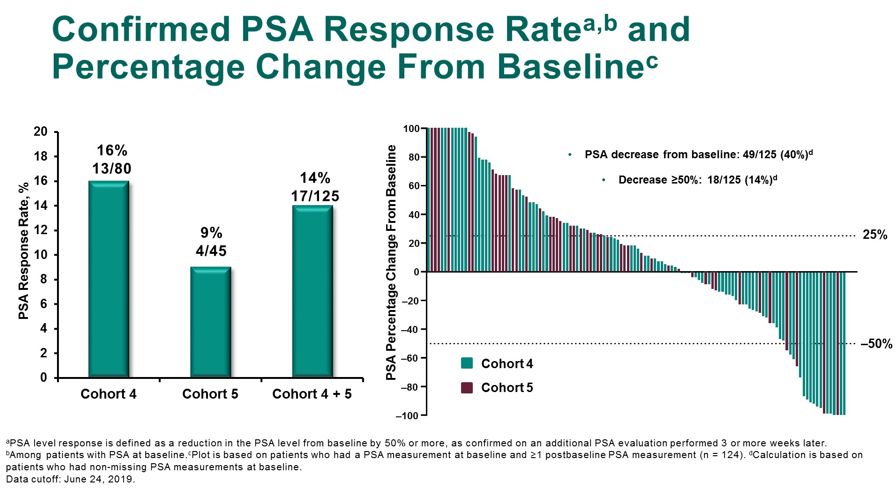 图8 确认PSA缓解率
图8 确认PSA缓解率
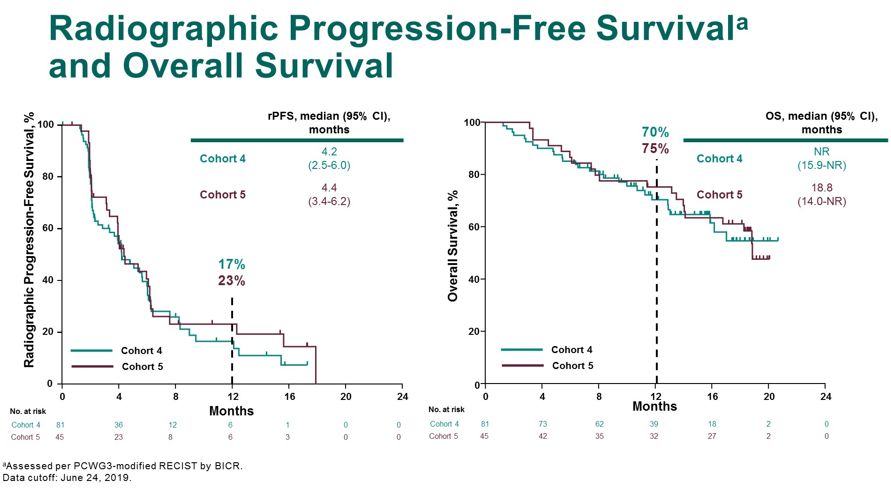 图9 rPFS和OS
图9 rPFS和OS
KEYNOTE-199队列4、5的研究结果表明,恩扎卢胺抵抗后在恩扎卢胺基础上联合帕博利珠单抗具有适度的抗肿瘤活性,并且在RECIST-可测量和骨转移为主的mCRPC患者上表现出持久的缓解,该组合具有可控的安全性并且正在进行3期临床试验(KEYNOTE-641,NCT03834493)的评估[8]。
现有很多针对mCRPC的新药正在研发当中,其中有针对DNA损伤修复通路的PARP抑制剂、免疫检查点抑制剂、针对PI3K通路的靶向药物等。这些新的药物都在如火如荼地开展研究中,也出现了很多令人欣喜的结果,但面对如此多种类的药物,我们应当如何选择,如何组合?
阿比特龙是国际国内各大指南推荐的mCRPC治疗药物,COU-AA-302研究证实阿比特龙相较于安慰剂能延长化疗前mCRPC患者的OS(34.7个月 vs 30.3个月,HR=0.81,95%CI 0.70-0.93;p=0.0033)和rPFS(16.5个月 vs 8.3个月,HR=0.53,95%CI 0.45-0.62;p<0.001)[9]。
阿比特龙联合其他药物,是否能带来1+1>2的效果呢?今年ASCO-GU大会上为我们呈现了阿比特龙联合骨吸收抑制剂/化疗/PARP抑制剂的研究结果。基于国际多中心数据库的回顾性研究结果显示,阿比特龙联合骨吸收抑制剂一线治疗骨转移CRPC患者可延长OS,尤其高肿瘤负荷患者OS获益更显著,但联合治疗组的至骨相关事件时间更短,尤其低肿瘤负荷患者出现骨相关事件的风险更高,这些数据提示阿比特龙联合骨吸收抑制剂对于高/低肿瘤负荷的患者可能具有不同的临床结局影响。
一项Ⅱ期研究结果显示,阿比特龙联合卡巴他赛相较于阿比特龙显著延长化疗前mCRPC患者的rPFS、至PSA进展时间、OS和PSA缓解率,未来可能进一步探索阿比特龙+卡巴他赛这一组合在mCRPC中的应用。PARP抑制剂与雄激素受体靶向药物的联合应用也成为近期mCRPC治疗领域的研究热点,阿比特龙联合Niraparib 1b期研究结果提示耐受性良好,目前3期研究正在进行,研究结果值得期待。
免疫疗法在多个癌种中展现了惊人的疗效,但前列腺癌是“冷”肿瘤,肿瘤微环境中存在的T细胞较少,单一的免疫检查点抑制剂在前列腺癌领域的成功很有限。2期KEYNOTE 199研究队列1-3的结果显示,在先前接受过新型内分泌治疗和多西他赛的mCRPC患者中,接受帕博利珠单抗单药治疗的ORR仅有3%-5%[10]。
研究者尝试免疫联合疗法去解决这一难题,此次ASCO-GU大会上更新了KEYNOTE-365三种联合方案的数据:帕博利珠单抗联合奥拉帕利在先前接受过多西他赛和新型内分泌治疗、分子水平未经选择的mCRPC患者中的抗肿瘤活性;帕博利珠单抗联合多西他赛在新型内分泌治疗失败后的mCRPC患者中的抗肿瘤活性;帕博利珠单抗联合恩扎卢胺在阿比特龙失败后的mCRPC患者中的抗肿瘤活性。
此外,KEYNOTE-199队列4、5也更新研究结果,提示帕博利珠单抗联合恩扎卢胺治疗恩扎卢胺抵抗的mCRPC患者具有适度的抗肿瘤活性。免疫联合疗法在转移性去势抵抗性前列腺癌中的有效性和安全性将会进一步在3期研究中进行评估,包括KEYLYNK-010(帕博利珠单抗+奥拉帕利)、KEYNOTE-641(帕博利珠单抗+恩扎卢胺)和KEYNOTE-921(帕博利珠单抗+多西他赛)。免疫检查点的发现及免疫治疗的进展是近几年肿瘤治疗关注热点,未来随着更多研究结果的发表,相信免疫治疗将为前列腺癌患者带来更多获益。
目前多种新型药物以及联合治疗方案均在探索中,总体上,不管是单药还是联合治疗,ORR和有效时间对临床结果的改善仍然有限。如何选择最佳的治疗方案,如何合理的组合,是mCRPC临床诊疗中所面临的最大挑战。
随着无创液体活检、二代基因测序等技术的发展,帮助选择或排除特定疗法的特异性生物标志物成为研究的热点,其有望指导mCRPC患者的个体化治疗。通过治疗前后动态监测具有临床决策指导价值的标志物水平,了解不同个体、不同时间点前列腺肿瘤细胞的主要生物学特征,来指导相应的个体化治疗方案,能够在治疗上达到更好的预后效果。现阶段,基于药物疗效预测的多基因组合物已开始在国内外应用。
目前所进行的临床研究,研究对象大都是欧美人群,很少针对亚裔人群,研究结果可能存在种族差异性。很多生物标记物的作用尚不清晰,预测作用不稳定,缺乏充分的前瞻性研究验证。同时,相关检测的成本普遍偏高,大规模应用会显著增加个人及社会的医疗负担。
在未来的研究中,基因水平生物标志物研究的重点在于挖掘新型的标志物或标志物组合,并明确其与前列腺癌治疗选择的相关性,以及更为便捷精确的低成本检测方法,从而实现以分子水平生物标记物指导下的mCRPC患者的精准联合治疗。
董柏君教授
董柏君,博士,硕士生导师,上海交通大学医学院附属仁济医院泌尿科副主任医师,美国MD安德森癌症中心博士后,上海市泌尿外科学会青年委员会副主任委员,中国临床肿瘤学会前列腺癌专家委员会委员,中华医学会泌尿外科分会青年委员会委员兼转化医学学组副组长,中国医师协会泌尿外科分会青年委员,《中华泌尿外科杂志》通讯编委。主要从事泌尿系肿瘤特别是前列腺癌的早期诊断和微创治疗,擅长前列腺精准无痛靶向穿刺,前列腺癌的微创治疗,前列腺癌冷冻消融、纳米刀等超微创手术,前列腺癌分子诊断和精准治疗,神经内分泌前列腺癌的个体化综合治疗。以负责人申请国家自然基金面上项目1项、上海市科委等省部级科研项目3项、上海市卫健委和市教委项目各1项,以第一或通讯作者发表SCI收录论文39篇,获2017年上海市人才发展资金资助,2019年上海市教委高峰高原学科建设计划研究型医师资助。
参考文献
[1]Edoardo Francini, et al. Clinical outcomes of abiraterone acetate + prednisone (AA) + bone resorption inhibitors (BRI) versus AA alone as first-line therapy for castration-resistant prostate cancer (CRPC) with bone metastases (BM) in an international multicenter database. 2020 ASCO GU abstract 30
[2]Susan F.Slocin, et al. Abiraterone acetate (AA) with or without cabazitaxel (CBZ) in treatment of chemotherapy naïve metastatic castration-resistant prostate cancer (mCRPC). 2020 ASCO GU abstract 84
[3]Fred Saad, et al. Phase Ib study of niraparib plus androgen receptor-targeted therapy (ART) in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC).2020 ASCO GU abstract 122.
[4]Kim N chi, et al. A phase 3 randomized, placebo-controlled, double-blind study of niraparib plus abiraterone acetate and prednisone versus abiraterone acetate and prednisone in patients with metastatic prostate cancer (MAGNITUDE). 2020 ASCO GU abstract TPS 257.
[5]Evan Y. Yu, et al. KEYNOTE-365 cohort A updated results: Pembrolizumab (pembro) plus olaparib in docetaxel-pretreated patients (pts) with metastatic castration-resistant prostate cancer (mCRPC).2020 ASCO GU abstract 100.
[6]Michael Paul Kolinsky, et al. KEYNOTE-365 cohort B updated results: Pembrolizumab (pembro) plus docetaxel and prednisone in abiraterone (abi) or enzalutamide (enza)-pretreated patients (pts) with metastatic castrate-resistant prostate cancer (mCRPC). 2020 ASCO GU abstract 103.
[7]William R. Berry, et al. KEYNOTE-365 cohort C updated results: Pembrolizumab (pembro) plus enzalutamide (enza) in abiraterone (abi)-pretreated patients (pts) with metastatic castrate-resistant prostate cancer(mCRPC). 2020 ASCO GU abstract 102.
[8]Julie Nicole Graff, Pembrolizumab (pembro) plus enzalutamide (enza) for enza-resistant metastatic castration-resistant prostate cancer (mCRPC): KEYNOTE-199 cohorts 4-5. 2020 ASCO GU abstract 15.
[9]Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2015;16(2):152–160. doi:10.1016/S1470-2045(14)71205-7
[10]Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2015;16(2):152–160. doi:10.1016/S1470-2045(14)71205-7
以上是关于珠联璧合 | mCRPC联合治疗的研究进展的主要内容,如果未能解决你的问题,请参考以下文章