文献解读图像识别预测病理分期研究思路
Posted 生信人
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了文献解读图像识别预测病理分期研究思路相关的知识,希望对你有一定的参考价值。
基于CT图像特征分析的机器学习算法预测非小细胞肺癌病理分期
研究共纳入145例病理证实的IA-IV期NSCLC患者。患者队列由三个数据集组成,包括NSCLC(n = 87),LUAD(n = 24)和LUSC(n = 34)。NSCLC样本平均分为训练集和测试集,而LUAD和LUSC数据集用于外部验证。NSCLC,LUAD和LUSC队列患者的临床病理特征如表1所示。纳入标准为新诊断或未经治疗的NSCLC和病理证实的IA-IV期肺腺癌和鳞状细胞癌,以及治疗前的CT图像。排除标准是接受手术或化学放射治疗并且包含不正确的分期信息的患者。TRIPOD核对表附加为附加文件1:表S1。
表1训练和验证集中的患者和肿瘤特征
1.通过3D切片器软件进行病变识别和感兴趣区域分割
所有患者图像均以原始DICOM格式加载和处理。使用3D-Slicer软件加载CT图像文件和RTSTRUCT文件用于映射病变的子区域。应用段编辑器模块将主表示从平面轮廓更改为二进制标签贴图。3D图像文件和二进制掩模标记文件由3D切片器保存为NRRD格式文件,用于下一个特征提取步骤。
2.使用Pyradiomics从CT图像中提取特征
使用python包pyradiomics来执行特征提取任务。一些定量特征如下:一阶特征,形状特征,灰度共生矩阵(GLCM)特征。除了形状特征之外,还可以在原始图像或派生图像上测量其他特征。
3.数据预处理
首先应该确认NSCLC队列的原始类别分布是否平衡。如果不是,则通过SMOTE算法进行过采样,以解决机器学习中数据集不平衡,并通过生成新的数据集来实现类分布的均衡,然后将新生成的数据集分成训练集和测试集。
4.预测建模和特征选择
考虑到可能影响预测模型分类精度的一些冗余和不相关的特征,通过随机森林算法计算CT图像特征的重要性值,然后根据特征重要性选择最佳特征(平均减少基尼杂质> 0.005)用于建模。在这里,使用袋外(OOB)误差评估随机森林的分类准确度,该误差是随机森林推广误差的无偏估计。使用python模块scikit-learn使用默认参数执行上述所有建模过程。鉴于每个阶段的样本量有限,对早期(阶段I / II)和后期(阶段III / IV)的二值化阶段进行了所有上述分析。
5.预测模型的分类准确性
为了评估训练和测试集中预测模型的性能,绘制接收器操作特征(ROC)曲线以显示测试集和外部验证集中的分类性能。ROC曲线是反映连续变量的假阳性率和真阳性率的综合指数。曲线下面积(AUC)是模型性能的评估量度。
使用分类器的混淆矩阵作为其质量的度量,用准确度分数,正确分类的样本数量与所有样本数量的比率,来检查预测结果和实际结果之间是否存在一致性。最后,使用原始特征计算一个新模型,其精度分数可以根据所选择的最优特征来计算。
6.使用精确回忆曲线评估预测模型
除了使用ROC曲线评估预测模型的准确性之外,还使用Precision-Recall度量来估计分类器的输出质量。在使用精度和召回度量等性能度量的不平衡数据集评估二元分类器时,精确调用曲线更具信息性。两者的高分表明分类器返回准确的结果(高精度),以及返回大部分所有正面结果(高召回率)。而且,f1得分越高,分类模型越稳定。考虑到单一指标 - 精度,召回和f1得分的限制,对每个分类采用平均精确分数和精确召回来评估总体容量。平均精度(AP)用于使用在每个阈值处实现的精确度的加权平均值来测量分类器的准确度。如果精确回忆曲线和平均精度扩展到多类或多标签分类,则输出将被二值化。可以通过考虑标签指示符矩阵的每个元素来绘制精确回忆曲线。
结果:共有145例病理诊断为NSCLC,包括LUSC,LUAD或其他NSCLC亚型。在87名NSCLC患者的测试组中,有58名男性患者和29名女性患者。由24名患者组成的LUAD队列和由34名患者组成的LUSC队列分别用于模型的外部验证。如表1所示,在测试集和性别验证集之间未发现差异(P = 0.14),而在临床病理阶段三个队列之间存在显着差异(P = 0.02)。来自TICA数据库的NSCLC患者的临床信息在附加文件2:表S2中提供。
表2特征重要性

通过对各组数据的观察,确定了训练集中原始NSCLC样本的不平衡类分布(图1a),然后使用随机过采样进行过采样。用机器学习算法SMOTE为以下分析生成新的平衡数据集(图1b),通过随机森林算法(表2)计算CT图像特征的重要性值,然后选择基于每个特征重要性的最佳特征(平均减少基尼杂质> 0.005),总共选择了九个图像特征作为阶段预测图像生物标记进行建模。这些特征分别是wavelet-HHH_firstorder_RootMeanSquared, log-sigma-2-0-mm-3D_firstorder_RootMeanSquared,waveletHHL_glcm_InverseVariance,wavelet-HHL_glcm_Idn,wavelet-HHL_firstorder_Variance,wavelet-HHL_glszmSmallAreaHighGrayLevelEmphasis,wavelet-HHL_glcm_InverseVariance,wavelet-HHL_glcm_Imc1,waveletHHL_glrlm_LongRunLowGrayLevelEmphasis。最终,使用OOB误差评估模型的分类精度。
在分类精度方面,混淆矩阵结果证实预测结果与实际结果之间存在一致性,这表明模型在多类对象分类中具有更好的性能(图1c)。此外,ROC曲线分析还证实该模型可以预测和区分NSCLC的病理分期,高精度为0.69~1.00(图1d)。原始随机森林模型和有限特征模型的准确度分数分别为0.53和0.57。除了准确度得分之外,还从平均精度得分和每个级别的精确回忆的角度评估预测模型。如精确回忆曲线所示(图1e,f),预测模型不仅产生了更高的平均精度得分(AP)0.60(图1e),而且在NSCLC的病理分期方面取得了更好的诊断性能。精确回忆曲线扩展到多类(图1f)。二值化阶段场景的相应结果如图2所示。
除了上面的内部测试之外,使用LUAD和LUSC数据集对预测模型的性能进行了外部验证。LUAD队列(图3a)和LUSC队列(图3b)中的样本的原始类分布显示在图4中。外部验证中的机器学习算法与测试集中使用的相同。就LUAD数据集中的分类器性能而言,混淆矩阵和ROC曲线均表明模型的高分类精度,AUC值为0.69~1.00(图3c,d),重新确认LUSC数据集中预测结果与实际结果之间的一致性(图3e)。 ROC曲线还显示,该模型可以区分LUSC的病理分期,高精度至少65%(图3f)。
在外部验证集中的精确回忆曲线表明,预测模型不仅在LUAD(AP = 0.84)和LUSC(AP =0.62)中获得更高的平均精度得分(图5a,c),在精确回忆曲线向多类的扩展方面,LUAD和LUSC的病理分期产生了更好的分化表现(图5b,d)。预测模型结合了九个图像特征,可以准确地预测和区分NSCLC的病理分期,并且LUAD模型的预测准确性优于LUSC。二值化阶段情景的相应结果如图4所示。此外,如附加文件3:表S3所示,分别评估放射性评分和TNM因子之间的关联,并且在NSCLC数据集中发现了类似的结果。
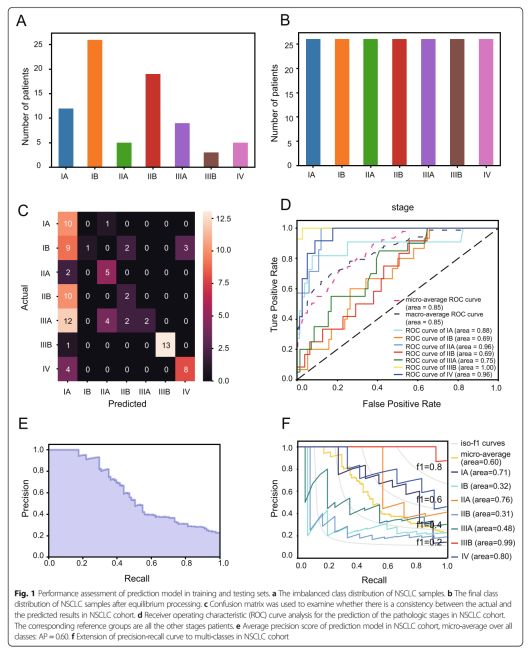
图1训练和测试集中预测模型的性能评估
a NSCLC样本的不平衡类分布。
b平衡处理后NSCLC样品的最终分类。
c混淆矩阵用于检查NSCLC队列中的实际结果和预测结果之间是否存在一致性。
d接收器操作特征(ROC)曲线分析,用于预测NSCLC队列中的病理分期。相应的参考组是患者的所有其他阶段。
e NSCLC队列中预测模型的平均精度得分,所有类别的微观平均值:AP = 0.60。
f将精确回忆曲线扩展到NSCLC队列中的多类
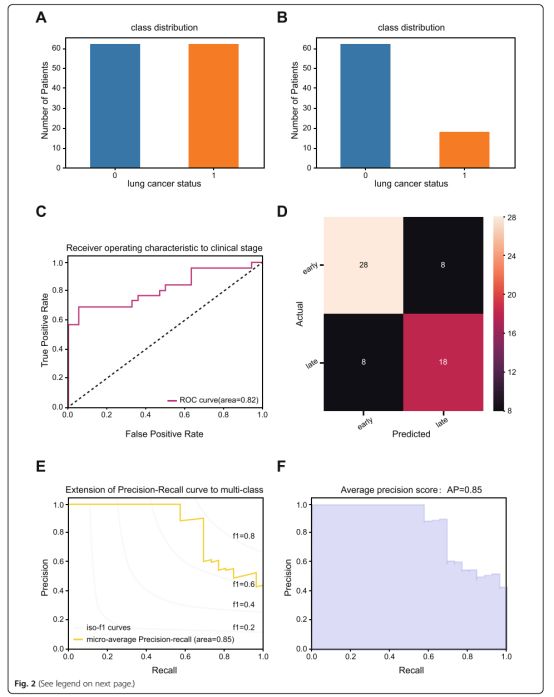
图2二值化预测场景中训练/测试集预测模型的性能评估
a NSCLC样本的不平衡类分布。
b平衡处理后NSCLC样品的最终分类。
c接收器操作特征(ROC)曲线分析,用于预测NSCLC队列中的病理分期。
d混淆矩阵用于检查NSCLC队列中的实际结果和预测结果之间是否存在一致性。
e NSCLC队列中的精确回忆曲线。
f NSCLC队列中预测模型的平均精度得分
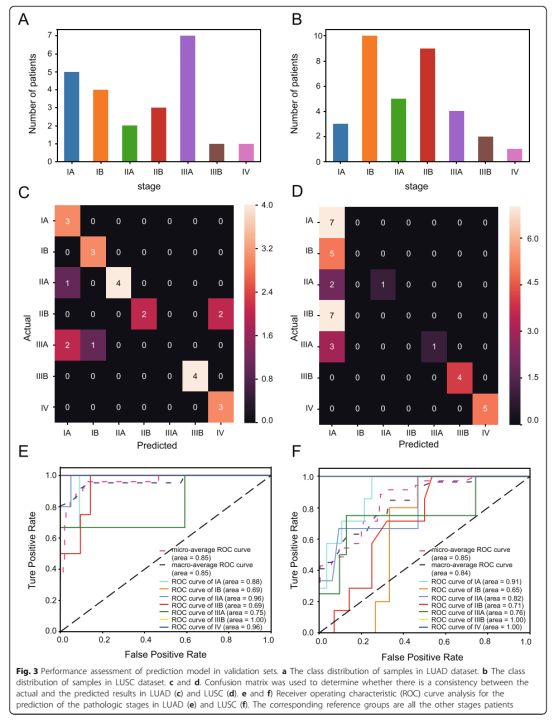
图3验证集中预测模型的性能评估
a LUAD数据集中样本的类分布。
b LUSC数据集中样本的类分布。
c d混淆矩阵用于确定LUAD(c)和LUSC(d)中的实际结果和预测结果之间是否存在一致性。
e f接收器操作特征(ROC)曲线分析,用于预测LUAD(e)和LUSC(f)中的病理阶段。 相应的参考组是患者的所有其他阶段
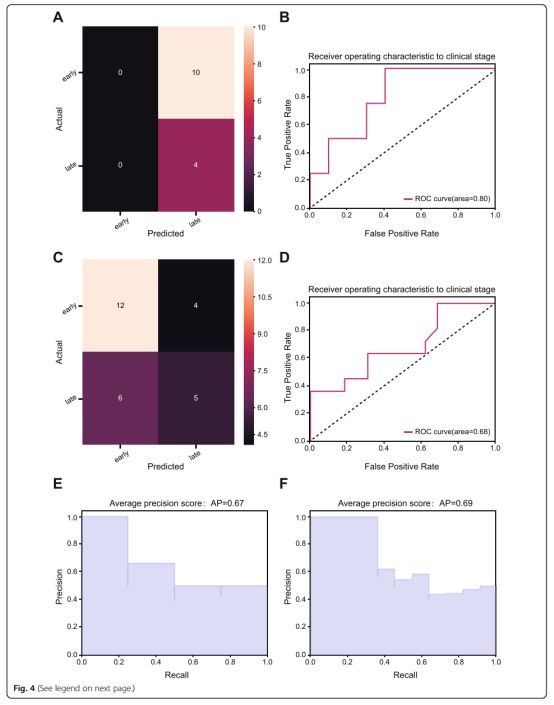
图4验证集中预测模型的性能评估
在二值化预测方案中,a c混淆矩阵用于确定LUAD(上)和LUSC(下)中实际和预测结果之间是否存在一致性
b d接收器操作特征(ROC)曲线分析,用于预测LUAD(上)和LUSC(下)的病理分期e LUAD预测模型的平均精度得分
f LUSC中预测模型的平均精度得分
图5在验证集中的预测模型在精度和召回得分方面的性能评估
a LUAD中预测模型的平均精度得分,所有类别的微观平均值:AP = 0.84。
b将精确回忆曲线扩展到LUAD中的多类,相应的参考组是患者的所有其他阶段。
c LUSC中预测模型的平均精度得分,所有类别的微观平均值:AP = 0.62。
d将精确回忆曲线扩展到LUSC中的多类,相应的参考组是患者的所有其他阶段。
研究进一步探讨了机器学习在病理分期CT图像特征分析中的作用和应用,同时揭示了可用于NSCLC病理分期诊断和预测的潜在影像生物标志物。预测模型纳入了九个最佳特征,被证实在预测肺癌亚型和LUAD和LUSC的病理性肿瘤阶段方面非常有效。研究结果不仅扩展了机器学习算法在CT图像特征预测中用于病理分期的应用,而且还确定了可用于诊断和预测NSCLC病理分期的潜在成像生物标记物。
| | || | | value
| | | | |
| | | |
| | | | | |
以上是关于文献解读图像识别预测病理分期研究思路的主要内容,如果未能解决你的问题,请参考以下文章