2021 ASCO 精解ATM突变和BRCA2突变的mCRPC患者对紫杉醇和PARP抑制剂治疗反应的差异
Posted 泌尿科那点事儿
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了2021 ASCO 精解ATM突变和BRCA2突变的mCRPC患者对紫杉醇和PARP抑制剂治疗反应的差异相关的知识,希望对你有一定的参考价值。
ATM突变和BRCA2突变的mCRPC患者对紫杉醇和PARP抑制剂治疗反应的差异
背景: PARP抑制剂(PARPi)给携带DNA损伤修复基因突变(DDRm)的转移性去势抵抗前列腺癌(mCRPC)患者带来了新希望,但是ATM突变携带者(ATMm)和BRCA2突变携带者(BRCA2m)对PARPi的治疗反应可能不同。我们假设这种治疗差异也存在于紫杉醇类药物(TAX)中,以帮助解决治疗顺序的问题。
方法: 从美国8家医疗中心选择携带ATM或BRCA2突变的mCRPC患者137例。他们接受了TAX化疗,或PARPi治疗或两者兼有。收集患者的一般人口学、治疗和生存资料。Kaplan-Meier生存分析计算首次TAX或PARPi治疗开始到停药时间(TTD)和总体生存时间(OS)。Cox回归分析计算风险比(HR),并根据Gleason评分进行调整(≤7 vs. 8-10)。计算OS时,首次TAX或首次PARPi治疗后的后续治疗也作为协变量包括在内。
结果: 50例患者是ATMm和87例患者是BRCA2m。80%(40/50例)ATMm只接受TAX化疗或 TAXàPARPi序贯治疗,而20%(10/50)只接受PARPi治疗或PARPiàTAX序贯治疗。在ATMm患者中,首先TAX治疗与首先PARPi治疗比较,前者显示出TTD延长的趋势,但没有统计学差异(P=0.08,HR 0.50[95% CI: 0.24–1.08])。在所有首先TAX治疗的患者中,ATMm患者可以获得显著更长的TTD(P=0.04,HR 0.61[CI:0.37–0.99])。在ATMm患者中,首先TAX治疗的患者有更长的OS(P=0.06,HR 0.33[CI:0.10–1.05])。在BRCA2m患者中,49%(43/87例)首先TAX治疗,51%(44/87例)首先PARPi治疗。首先PARPi治疗与首先TAX治疗比较,前者可以获得显著更长的TTD(P<0.0001,HR 0.32[CI:0.19–0.56])。在所有首先PARPi治疗的患者中,BRCA2m患者可以获得显著更长的TTD(P=0.0031,HR 0.29[CI:0.12–0.66])。在BRCA2m患者中,PARPiàTAX和TAXàPARPi的治疗顺序在OS上没有显著性差异(P=0.63,HR1.18[CI:0.59–2.35])。
结论: 我们在ATMm和BRCA2m的mCRPC患者中的研究表明,在ATMm的患者中,TAX-PARPi序贯治疗有改善临床结果的趋势;而BRCA2m的患者则相反。
评论
这项回顾性研究的患者来自八家著名的美国医学中心,其中包括约翰.霍普金斯大学的 Sidney Kimmel综合癌症中心,哈佛大学的丹娜法伯癌症研究院,梅奥诊所等世界著名的医学中心。研究的目的是评估TAX和PARPi在mCRPC治疗中的活性,这些患者要么是ATM突变携带者,要么是BRCA2突变携带者。研究结果显示,在携带ATM基因突变的患者中,选择TAXPARP抑制剂的序贯治疗,可以获得总生存率和停药时间改善的趋势; 在携带BRCA2突变的患者中,选择PARP抑制剂TAX的序贯治疗,可以获得停药时间改善的趋势,但没有OS改善的趋势。 这一研究结果的重要意义是: (1)PARP抑制剂并不针对所有mCRPC患者,而是针对携带同源重组修复基因突变(Homologous recombination repair mutation, HRRm)的患者; (2)ATM和BRCA2虽然同为HRR基因家族成员,但二者对于PARP抑制剂的治疗反应仍存在差异。 (3)在我们迎接PARP抑制剂时代到来,或将来我们进入PARP抑制剂时代时,TAX,阿比特龙(ABI)和恩杂鲁胺(ENZA)这些经典的mCRPC治疗药物,仍可发挥重要作用,即使患者是HRRm携带者;因此,将来TAX,雄激素受体轴靶向药物和PARP靶向药物之间的序贯治疗问题,将是挑战临床医生的难点; (4)当前,PARP抑制剂的大部分数据都聚焦在mCRPC患者。随着,TAX,ABI和ENZA等药物治疗疾病阶段的前移,相信不久的将来我们也可以看到PARP抑制剂用于转移性激素敏感前列腺癌的治疗; (5)PARP抑制剂在临床广泛应用和接受,说明前列腺癌的治疗已经进入精准治疗的时代,患者在治疗前,应被推荐进行基因筛查。但是,当前我们需要改进生物标志物来告知哪些患者可能对治疗有反应,那些患者可能没有反应。
争议
AUA指南,NCCN指南和EAU指南均推荐,在TAX、ABI和ENZA等一线治疗失败后,携带有HRRm的mCRPC患者可以选择奥拉帕利治疗(图1)。但美国FDA已经批准了两个PARP抑制剂卢卡帕利(Rucaparib)和奥拉帕利(Olaparib)用于前列腺癌的治疗,但二者的适应症却有差异(图2)。作为第一款用于治疗晚期前列腺癌的PARP抑制剂,卢卡帕利批准的适应症是:用于治疗携带有害BRCA基因突变(胚系和/或体系)的mCRPC患者,这些患者先前已接受了雄激素受体靶向治疗或TAX化疗。而奥拉帕利批准的适应症是:用于治疗携带有害或可能有害的同源重组修复通路(HRR)基因突变(胚系或体系)的mCRPC患者,这些患者既往已接受过ENZA或ABI治疗。换而言之,奥拉帕利获批适应症不再限于BRCA1/2基因突变,还包括HRR家族中其他12个非BRCA基因突变,包括ATM、BARD1、BRIP1、CDK12、 CHEK1/2、 FANCL、PALB2、RAD51B/C/D和RAD54L等。
但是,对于非BRCA1/2基因突变携带者,特别是ATM突变携带者是否可以从PARP抑制剂治疗中获益目前仍存在争议。在著名的PROfound研究里面,研究者将BRCA1/2m和ATMm纳入A组中,而其他12个基因突变纳入B组,但是这样划分的生物学原因不清楚[1]。根据这个研究结果,A组患者可以获得比B组患者更好的影像学反应率和影像学无进展生存时间。基于这样的结果,ATM突变被认为对PARP抑制剂治疗有响应。但是最近的研究却发现,当A组和B组合并后分析显示,奥拉帕利的治疗效果明显减弱。亚组分析里,ATM基因突变患者没有影像学无进展生存获益(HR 1.04,95%CI 0.61-1.87)[2]。而Abida等人的研究结果也显示,ATM,CDK12和CHEK2等非BRCA基因突变患者从卢卡帕利的治疗中获得的影像学反应和PSA反应有限[3]。ASCO会议上的这篇摘要也支持ATM基因突变不是PARP抑制剂治疗的良好响应者。体外研究的结果也发现,ATM基因缺失的前列腺癌模型对PARP抑制剂的敏感性不一致[4]。
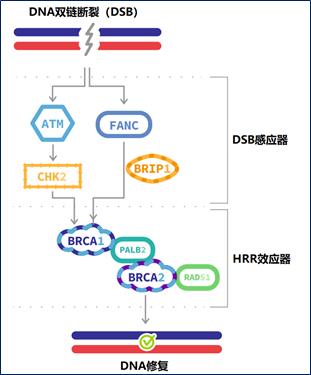
BRCA基因和ATM基因虽然同为同源重组修复通路(Homologous recombination repair pathways,HRR)中的成员,但其在DNA双链断裂(DNA double-strand break, DSB)修复中起到的作用不同。ATM扮演者DSB感应器的角色,而BRCA扮演着效应器的角色;即感应器(如ATM)发现DSB,然后招募效应器(如BRCA)在DNA损伤位置进行可靠修复(图3)[5]。目前仍不清楚在HRR基因家族中存在着这种差异的原因。除了每个基因对DNA损伤和修复的影响不同外,不同PARP抑制剂本身的差异也可能是一部分原因。我们还需要明确,在不同的个体中,这些特定基因的个体改变,在疾病发生和发展中起到的作用——哪些是真正的致病因素,哪些是旁观者而已。此外,单一基因突变的存在可能无法最终确定患者群体中HRR缺失。更多的功能性生物标志物,如全基因组杂合性缺失,才能为真正的HRR缺失提供足够的信息。
图1 2020年NCCN前列腺癌指南
图2 FDA批准的奥拉帕利和卢卡帕利用于mCRPC的适应症
图3 同源修复重组通路中的基因及其作用
Authors:
Christopher T Su, Emily Nizialek, Jacob E Berchuck, Panagiotis J. Vlachostergios, Ryan Ashkar, Alexandra Sokolova, Pedro C. Barata, Rahul Raj Aggarwal, Heather McClure, Nellie Nafissi, Alan Haruo Bryce, A. Oliver Sartor, Heather H. Cheng, Nabil Adra, Cora N. Sternberg, Mary-Ellen Taplin, Marcin Cieslik, Emmanuel S. Antonarakis, Ajjai Shivaram Alva; University of Michigan Rogel Cancer Center, Ann Arbor, MI;
Academic Centers:
1. Johns Hopkins Sidney Kimmel Comprehensive Cancer Center, Baltimore, MD;
2.Lank Center for Genitourinary Oncology, Dana-Farber Cancer Institute, Boston, MA;
3.Weill Cornell Medicine, New York, NY;
4.Indiana University Melvin and Bren Simon Cancer Center, Indianapolis, IN;
5.University of Washington, Seattle, WA;
6.Tulane Cancer Center, New Orleans, LA;
7.University of California, San Francisco, San Francisco, CA;
8.Mayo Clinic Arizona, Phoenix, AZ; Mayo Clinic, Phoenix, AZ
Background:
PARPi have shown promise in mCRPC pts with mutations in DNA repair, but ATM- and BRCA2-altered pts may respond differently to PARPi. We hypothesized that differences may also exist for taxane therapy, aiding in treatment sequencing decisions.
Methods:
mCRPC pts (N = 137) with deleterious ATM or BRCA2 mutations who received taxanes, PARPi, or both were identified from 8 US academic centers. Demographic, treatment, and survival data were collected. Kaplan-Meier analyses were performed for time-to-treatment-discontinuation (TTD), as well as overall survival (OS), from time of first taxane or PARPi therapy. Cox hazard ratio (HR) regression analyses were performed, adjusting for Gleason sum (≤7 vs. 8-10). For OS, receipt of subsequent therapies following first taxane or PARPi was also included as a covariate.
Results:
50 ATM- and 87 BRCA2-mutated pts were identified. 40/50 (80%) of ATM-mutated pts received taxane only or taxane prior to PARPi, while 10/50 (20%) received PARPi only or PARPi prior to taxane. ATM-mutated pts showed a trend towards longer TTD when taxane was given first vs PARPi given first (P = 0.08, adjusted HR for taxane treatment 0.50 [95% CI: 0.24–1.08]). Considering all pts who received taxane first, ATM-mutated pts had longer TTD than BRCA2-mutated pts who received taxane first (P= 0.04, adjusted HR for ATM 0.61 [CI: 0.37–0.99]). Among ATM-mutated pts, OS was longer in those receiving taxane first (P= 0.06, adjusted HR for taxane treatment 0.33 [CI: 0.10–1.05]). Among BRCA2-mutated pts, 43/87 (49%) received taxane first and 44/87 (51%) received PARPi first. BRCA2-mutated pts had longer TTD when PARPi was given first vs taxane given first (P< 0.0001, adjusted HR for PARPi treatment 0.32 [CI: 0.19–0.56]). Considering all pts who received PARPi first, BRCA2-mutated pts also had longer TTD than ATM-mutated pts who received PARPi first (P= 0.0031, adjusted HR for BRCA2 0.29 [CI: 0.12–0.66]). There was no significant OS difference in BRCA2-mutated pts regarding which treatment was given first (P= 0.63, adjusted HR for PARPi treatment 1.18 [CI: 0.59–2.35]).
Conclusions:
Our data in ATM- and BRCA2-mutated mCRPC pts suggests a trend towards improved clinical outcomes when taxanes are used prior to PARPi in ATM-mutated pts, while the reverse sequence appears to be better for BRCA2-mutated pts.
向上滑动阅览
【参考文献】
[1] Mateo J, Carreira S, Sandhu S, et al. DNA-Repair Defects and Olaparib in Metastatic Prostate Cancer. N Engl J Med. 2015 Oct 29;373(18):1697-708. doi: 10.1056/NEJMoa1506859.
[2] de Bono J, Mateo J, Fizazi K, et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2020 May 28;382(22):2091-2102. doi: 10.1056/NEJMoa1911440.
[3] Abida W, Campbell D, Patnaik A, et al. Non-BRCA DNA Damage Repair Gene Alterations and Response to the PARP Inhibitor Rucaparib in Metastatic Castration-Resistant Prostate Cancer: Analysis From the Phase II TRITON2 Study. Clin Cancer Res. 2020 Jun 1;26(11):2487-2496. doi: 10.1158/1078-0432.CCR-20-0394.
[4] Neeb A, Herranz N, Arce-Gallego S, et al. Advanced Prostate Cancer with ATM Loss: PARP and ATR Inhibitors. Eur Urol. 2021 Feb;79(2):200-211. doi: 10.1016/j.eururo.2020.10.029.
[5] Teyssonneau D, Margot H, Cabart M, et al. Prostate cancer and PARP inhibitors: progress and challenges. J Hematol Oncol. 2021 Mar 29;14(1):51. doi: 10.1186/s13045-021-01061-x.


声明:本内容仅代表嘉宾观点,不代表学习联盟平台立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。转载请后台联系授权,侵权必究!
编辑:王靖
审核:王冬
热点视频推荐 以上是关于2021 ASCO 精解ATM突变和BRCA2突变的mCRPC患者对紫杉醇和PARP抑制剂治疗反应的差异的主要内容,如果未能解决你的问题,请参考以下文章