赞药审中心项目管理人联系方式细分至适应症了!
Posted 药时代
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了赞药审中心项目管理人联系方式细分至适应症了!相关的知识,希望对你有一定的参考价值。
(来源:驭时临床试验信息)
沟通更快更高效!近日发布CDE项目管理人联系方式细分至适应症,此前是按部门。小编整理分享药审中心CDE、审核查验中心CFDI、医疗器械技术审评中心CMDE最新联系方式、工作程序、各部职责如下:
项目管理人员公示信息
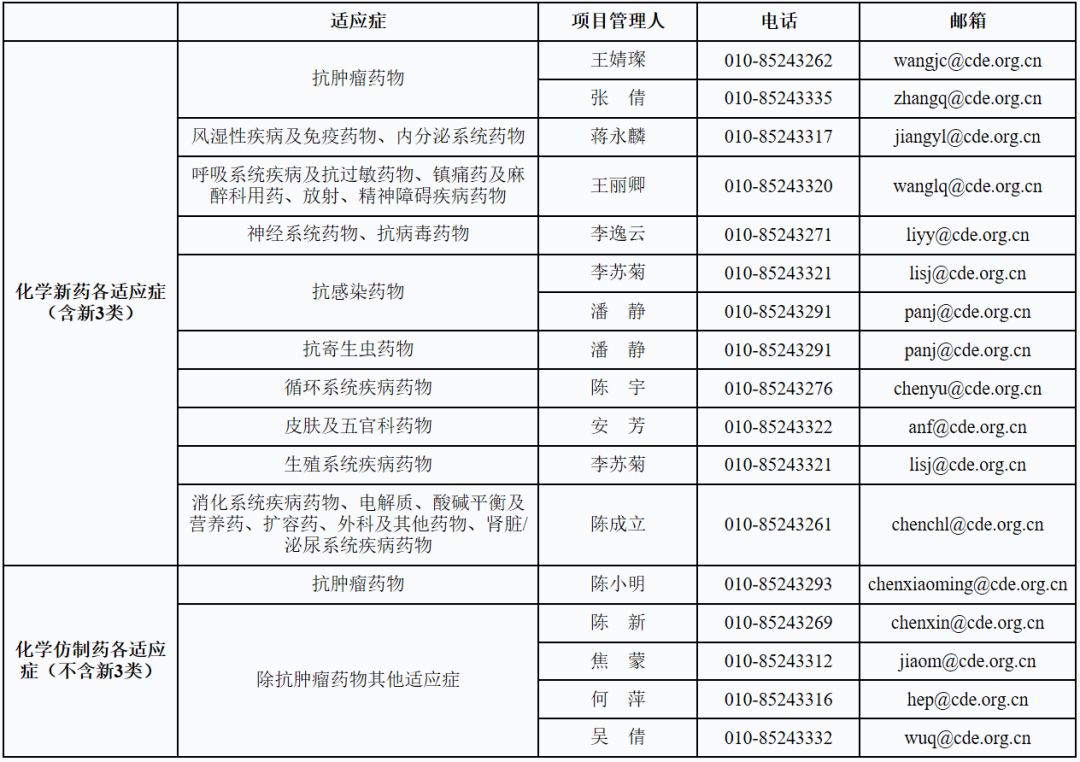
一、化药
二、中药

三、生物制品
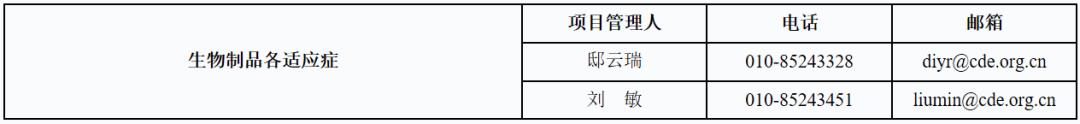
审评时间
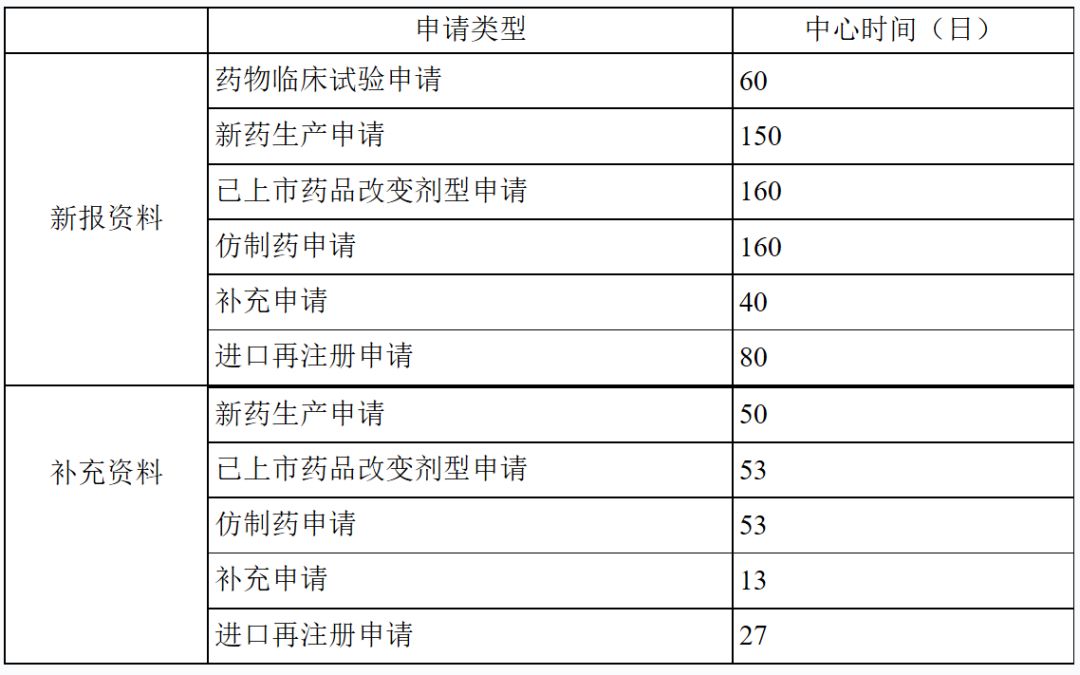
工作程序
平行审评程序
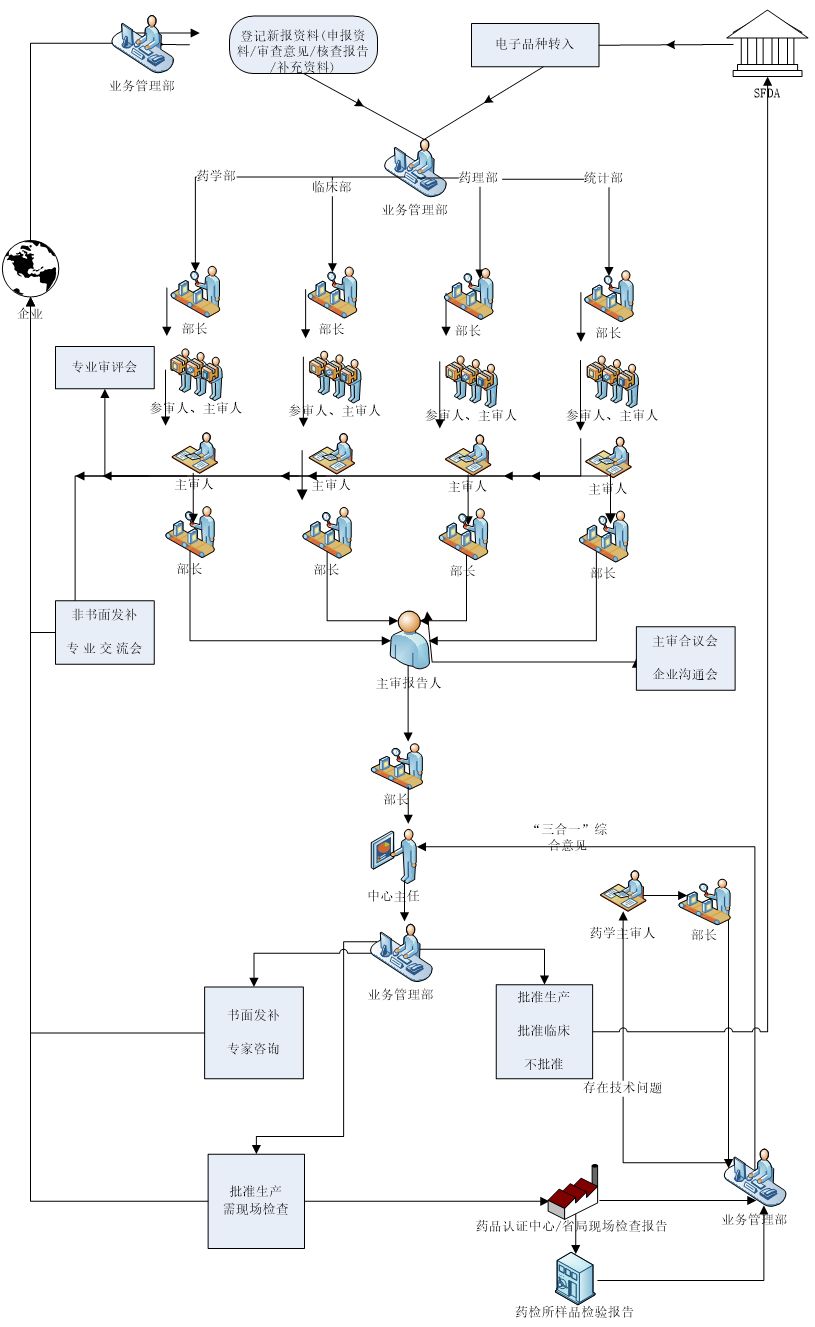
单专业审评程序(即单专业转序贯)
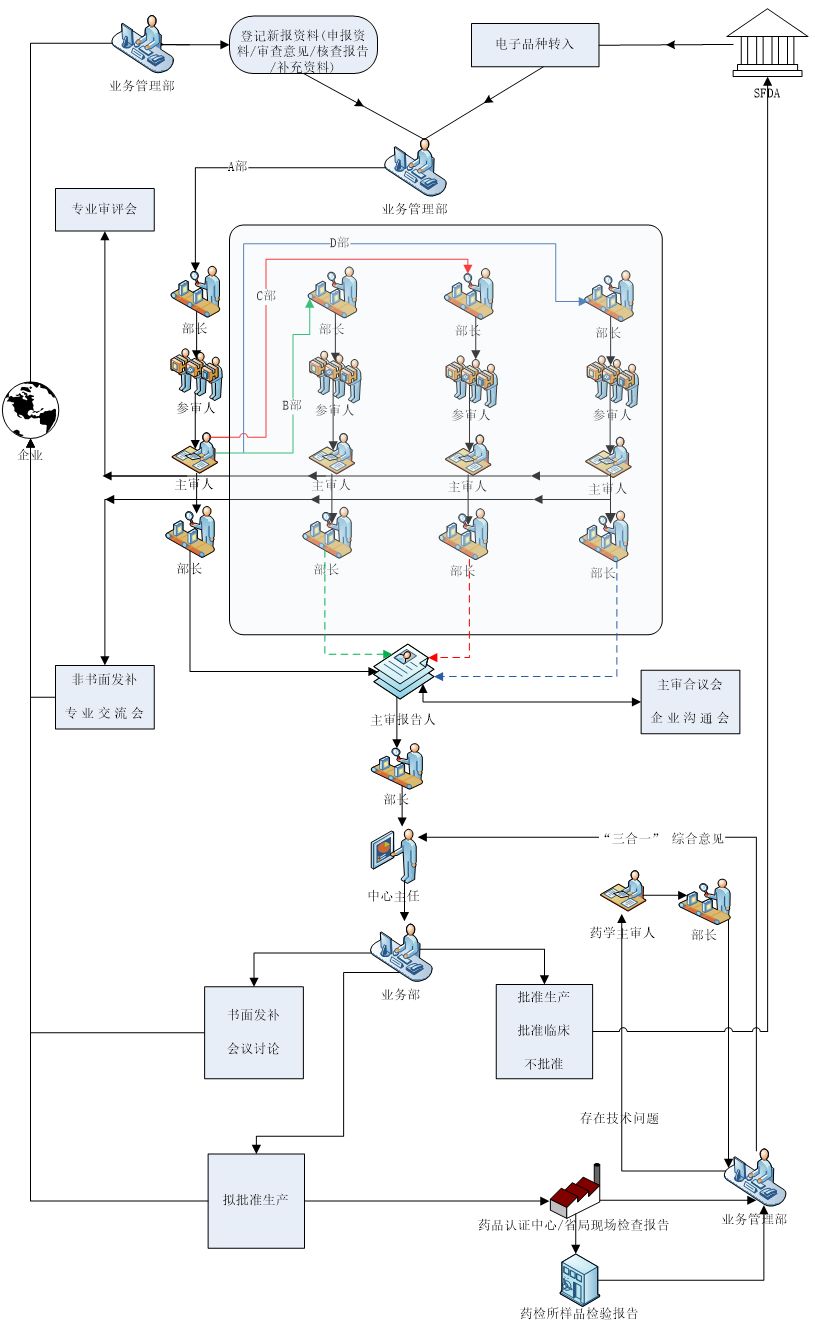
序贯审评程序
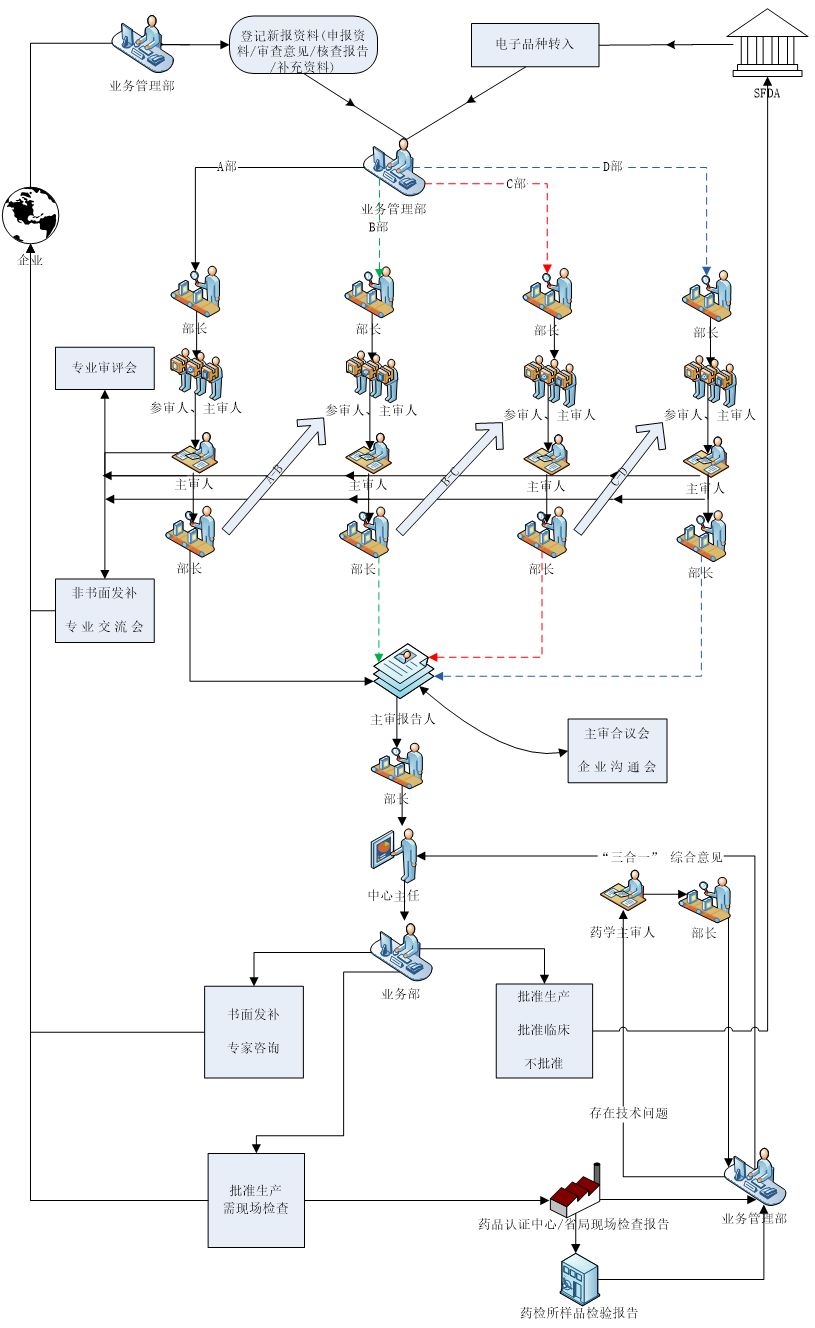

2、现场咨询时间为每周四上午8:30-11:00,下午1:00-4:00,咨询地点为北京市海淀区气象路50号院1号楼(知识产权出版社大厦一层)。
办公室
职能
制定中心事业发展相关规划并组织实施。负责中心行政事务和后勤保障工作。承担中心综合文稿起草、会议组织、公文处理、文书档案、政务信息、督察督办、安全保密、固定资产管理等综合工作。负责中心信息化建设,承担相关数据库的建设、维护和管理。组织实施中心宣传工作。承办中心交办的其他事项。
联系方式
办公室(传真):86452727
工作信箱:office@cmde.org.cn
综合业务处
职能
负责中心审评业务工作分派、日常管理和协调。组织开展创新医疗器械特别审批申请的审查工作。负责相关医疗器械产品注册资料的接受和运转、审评资料管理和档案查询工作。承担审评咨询专家库的日常管理工作,组织筹备各类审评会议。组织协调医疗器械注册核查工作。承办中心交办的其他事项。
联系方式
专家咨询组织筹备:86452920、86452924、86452948(传真)
补充资料收发:86452929、86452939(传真)
创新医疗器械特别审批审查:86452911
工作信箱:gcdivision@cmde.org.cn
质量管理处
职能
组织开展相关医疗器械产品注册技术审评规范依纪审评质量管理规章制度的制修订工作并监督实施。承担审评业务工作质量和效率的监督管理和绩效评价。组织开展相关业务咨询服务及学术交流活动。组织开展相关医疗器械产品技术审评政策研究。组织协调地方医疗器械技术审评工作的业务指导和技术支持。承办中心交办的其他事项。
联系方式
工作信箱:qmdivision@cmde.org.cn
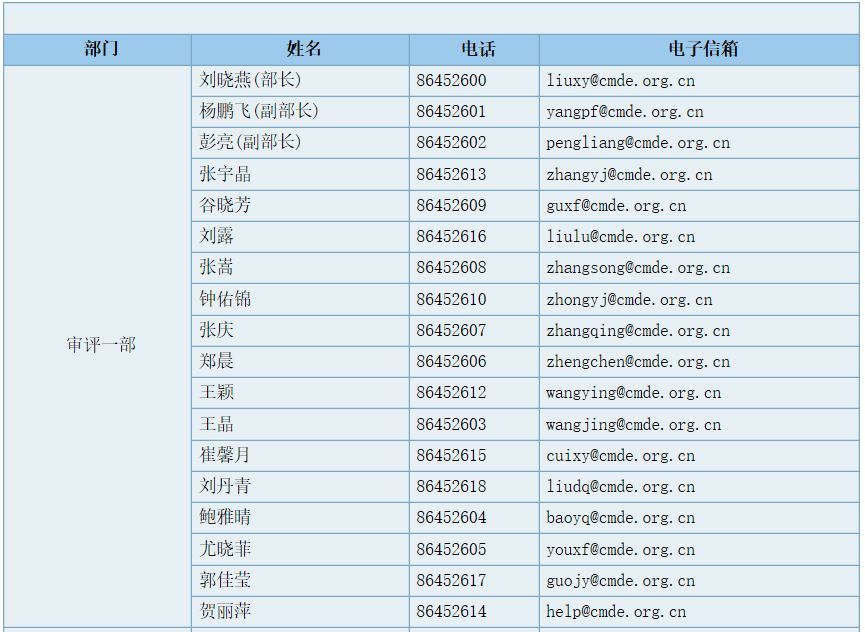
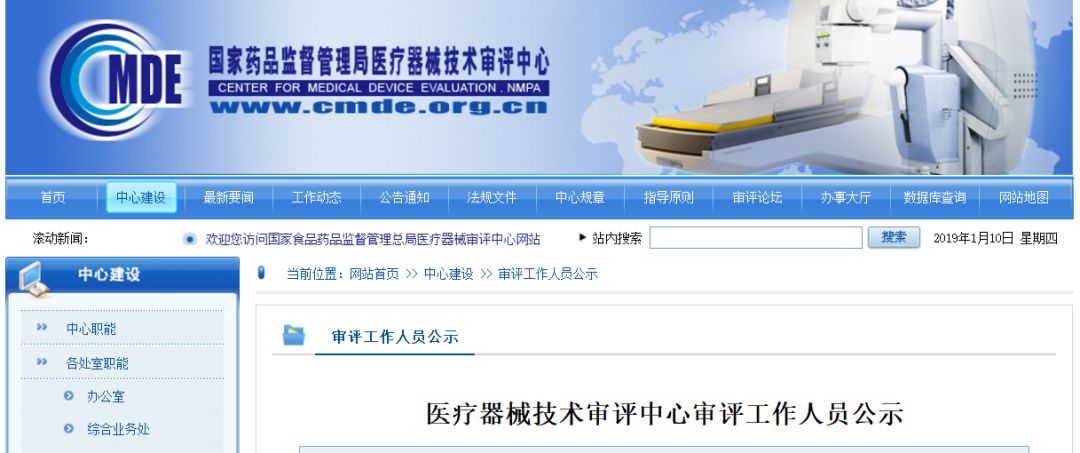
审评一部职能
负责对申请注册的医用X射线设备及医用磁共振设备等有源医疗器械产品进行技术审评。组织起草并实施相关专业医疗器械产品技术审评指导原则。承办中心交办的其他事项。
部长(传真):86452629,工作信箱:division1@cmde.org.cn
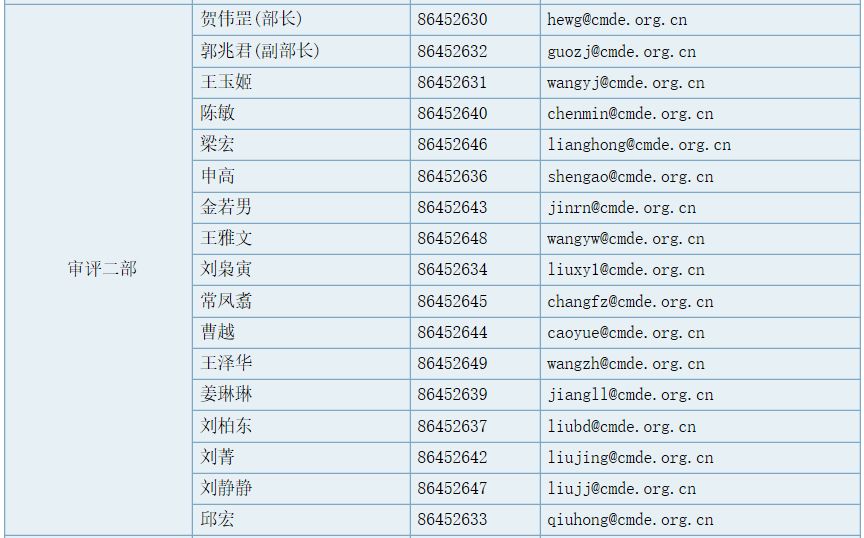
审评二部职能
负责对申请注册的医用超声及医用激光仪器设备等有源医疗器械产品进行技术审评;组织起草并实施相关专业医疗器械产品技术审评指导原则。承办中心交办的其他事项。
部长(传真):86452659 ,工作信箱:division2@cmde.org.cn
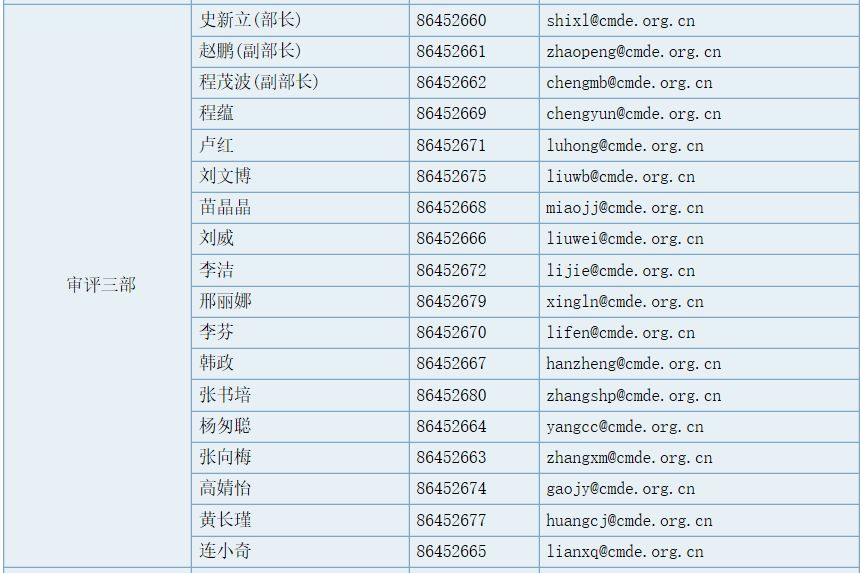
审评三部职能
负责对申请注册的血管支架、人工晶体、乳房植入物等植入材料和人工器官等无源医疗器械产品进行技术审评。组织起草并实施相关专业医疗器械产品技术审评指导原则。承办中心交办的其他事项。
部长(传真):86452689 ,工作信箱:division3@cmde.org.cn
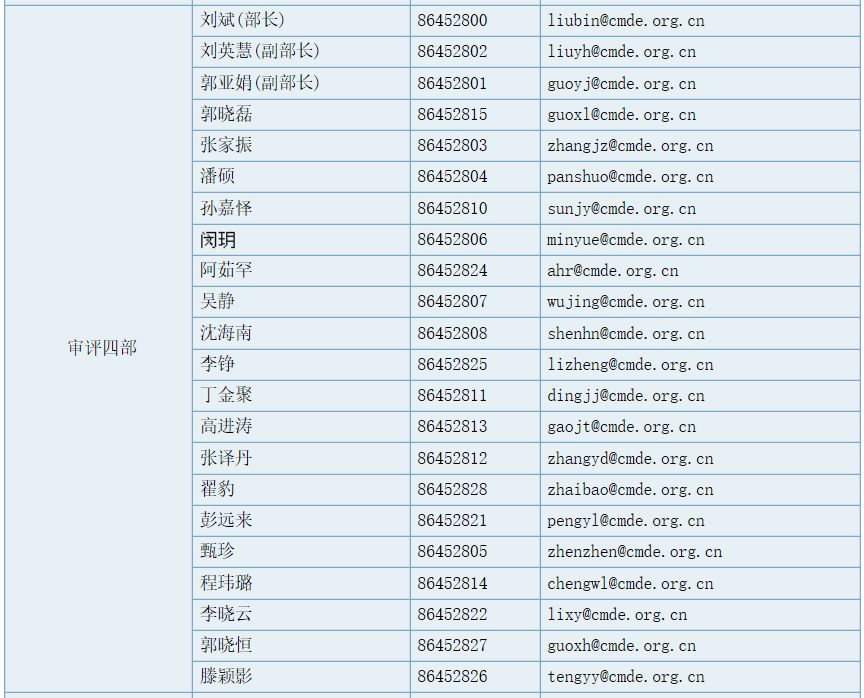
审评四部职能
负责对申请注册的骨科器械和口腔材料等无源医疗器械产品进行技术审评;组织起草并实施相关专业医疗器械产品技术审评指导原则。承办中心交办的其他事项。
部长(传真):86452829,工作信箱:division4@cmde.org.cn
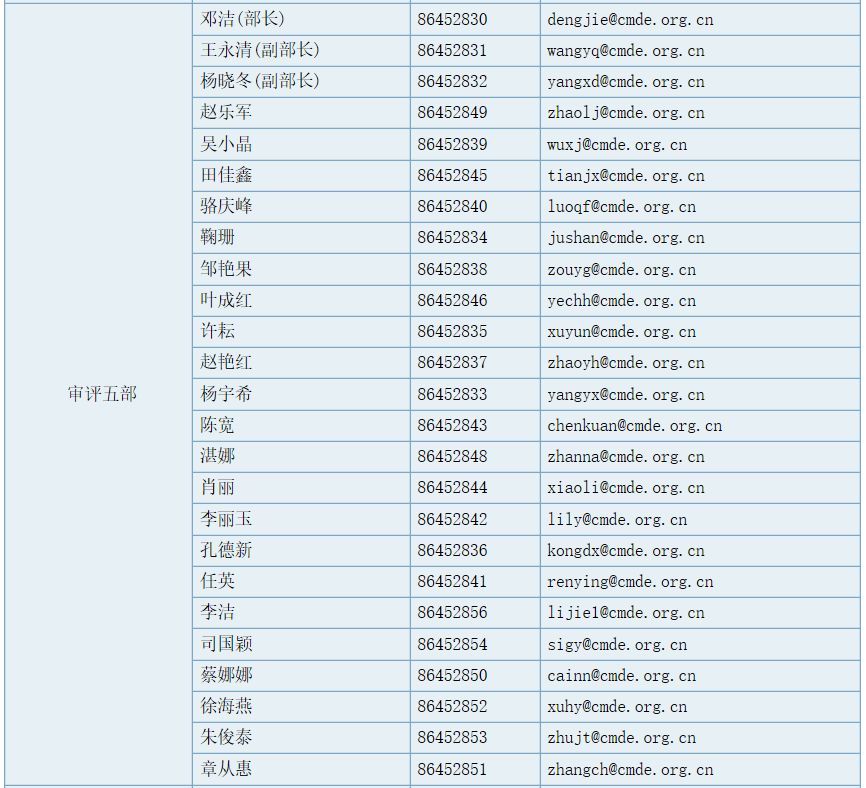
审评五部职能
负责对申请注册的注射穿刺器械及医用高分子材料及制品等无源医疗器械产品进行技术审评。组织起草并实施相关专业医疗器械产品技术审评指导原则。承办中心交办的其他事项。
部长(传真):86452859 ,工作信箱 :division5@cmde.org.cn
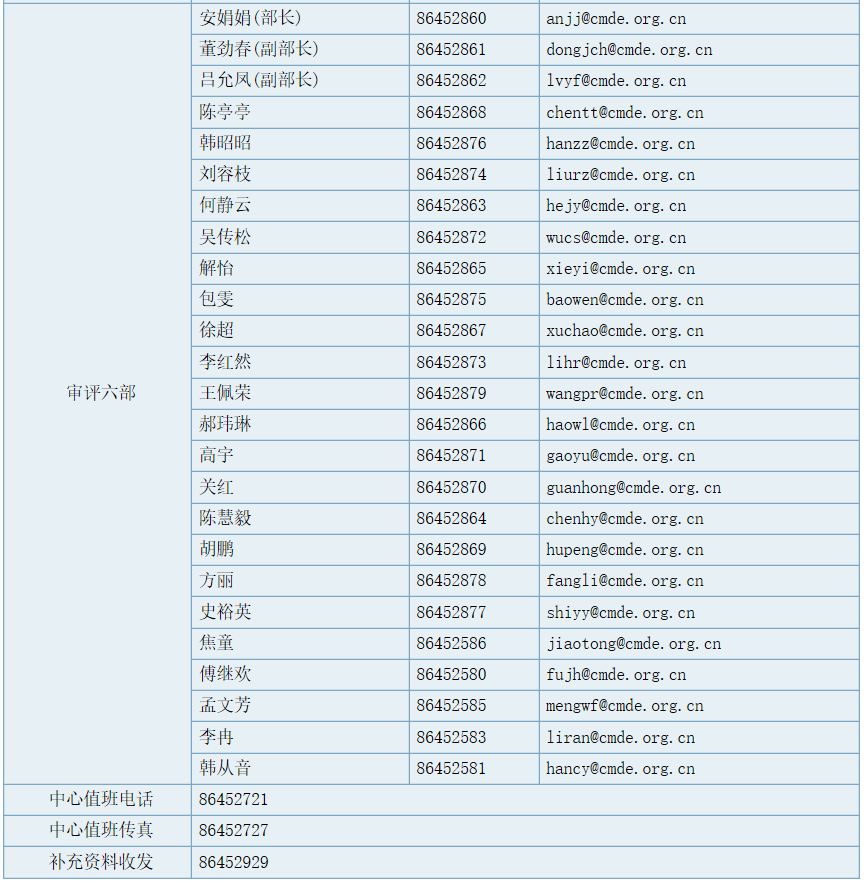
审评六部职能
负责对申请注册的临床检验仪器及体外诊断试剂进行技术审评;组织起草并实施相关专业产品审评指导原则。承办中心交办的其他事项。
部长(传真):86452889,工作信箱 :division6@cmde.org.cn
来源:NMPA官网

推 荐 阅 读
▼
欢迎联系我们!邮箱drugtimes@qq.com;微信27674131
以上是关于赞药审中心项目管理人联系方式细分至适应症了!的主要内容,如果未能解决你的问题,请参考以下文章