电池工作原理:一种通俗易懂的讲解
Posted 卓晴
tags:
篇首语:本文由小常识网(cha138.com)小编为大家整理,主要介绍了电池工作原理:一种通俗易懂的讲解相关的知识,希望对你有一定的参考价值。

01 电池工作原理
一、前言
电池是如何工作的? 很简单,只是利用的电池内部的酸性物质与两种不同的金属之间的化学反应。 其中一个金属带有更多的电子形成负极,另一个金属减少了电子形成正极。

那么如何使得电池工作呢?电池又是如何产生电流的呢? 在Kathy老师解释的过程中,可以了解到一些材料是导体、一些则是绝缘, 什么是电流、为什么所有电器专家和科学家都在维持一个共同的谎言、 自由电子和离子的重要性。通过化学来理解这一切都很简单。
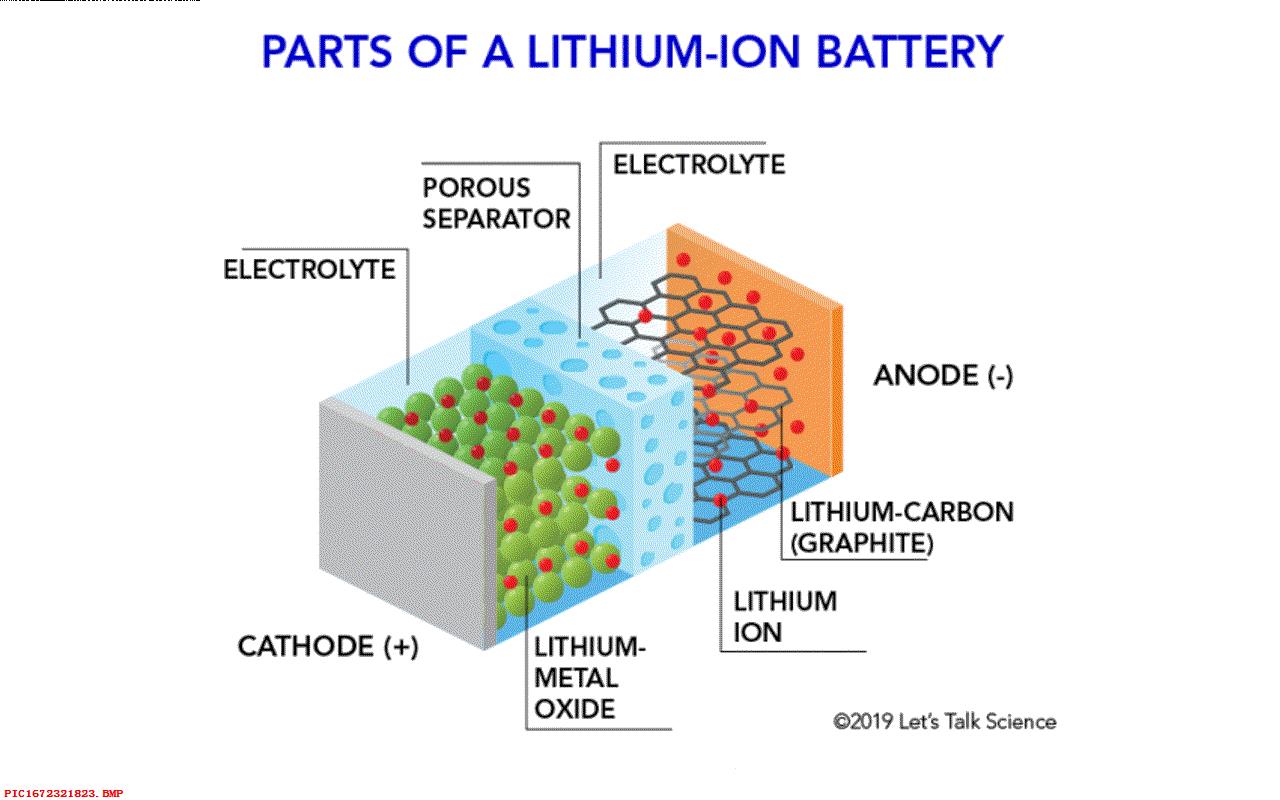

▲ 图1.1.1 不同的电池
二、导体和绝缘体
为了解释电池的工作原理,什么是电流,需要定义两个名词。 自由电子和正电荷离子。为此需要从基本概念说起。
原子是由带有正电荷大质量的核心,也称原子核以及外围带有负电荷的电子云组成, 电子云被原子核吸引并束缚在一起。
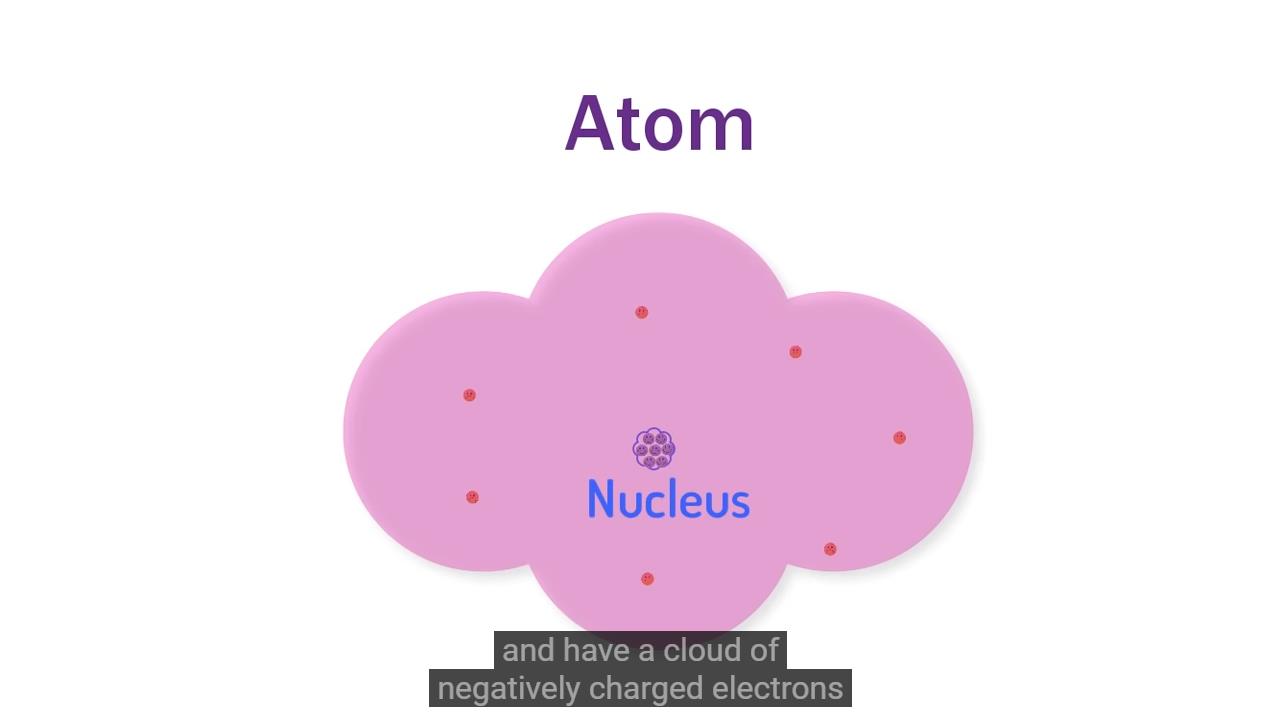
▲ 图1.1.2 原子钟的原子核以及外部的电子云
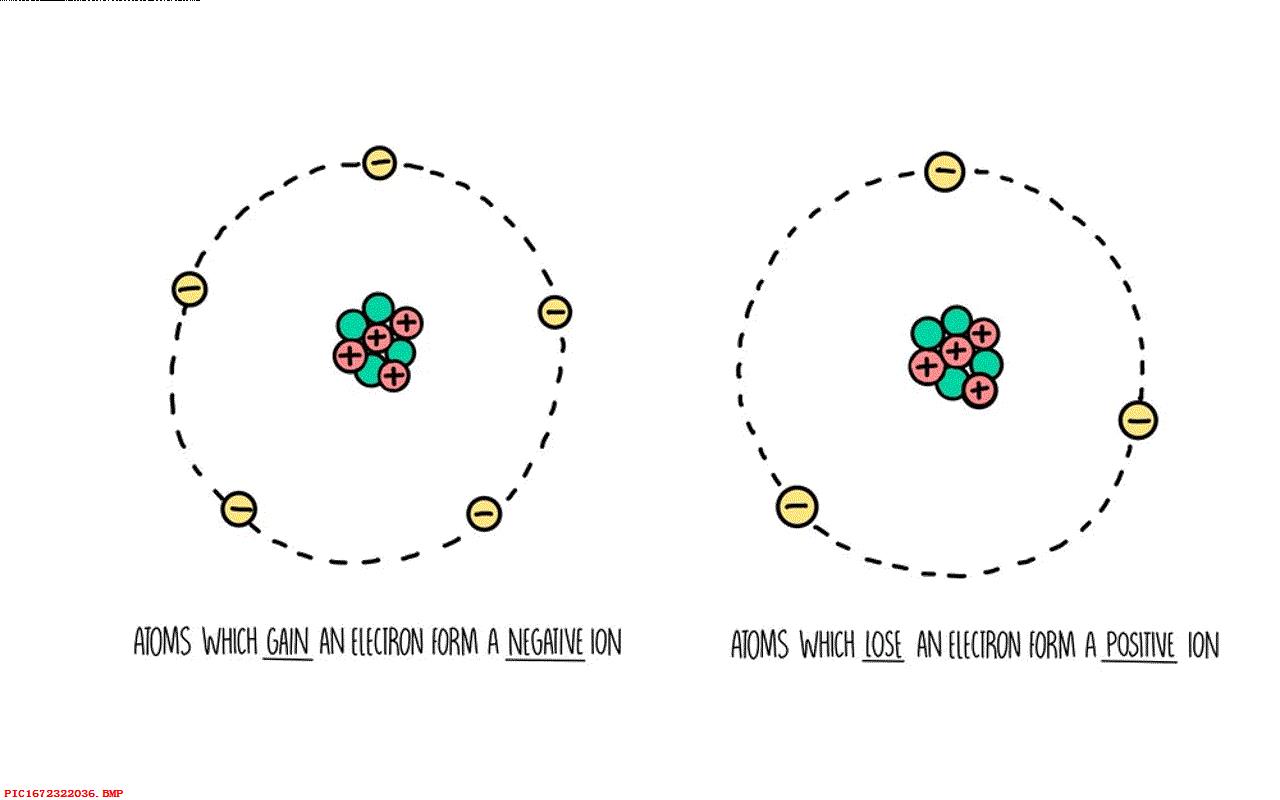
仅仅这些还不足以解释电流或者电。 然而对于一些原子它们对于外部的电子束缚并不紧密,它的电子比较容易脱离原子核的束缚而自由移动。 被称为自由电子,很形象,对吧。
当失去一部分电子之后,原子就有带有正电荷的原子核以及外部不足的电子组成,从而形成带有正电荷的离子。 在没有被重新捕获之前,这些自由电子并不属于任何一个特定的原子,以及带正电荷的离子,即那些丢失了一个或者两个电子的原子。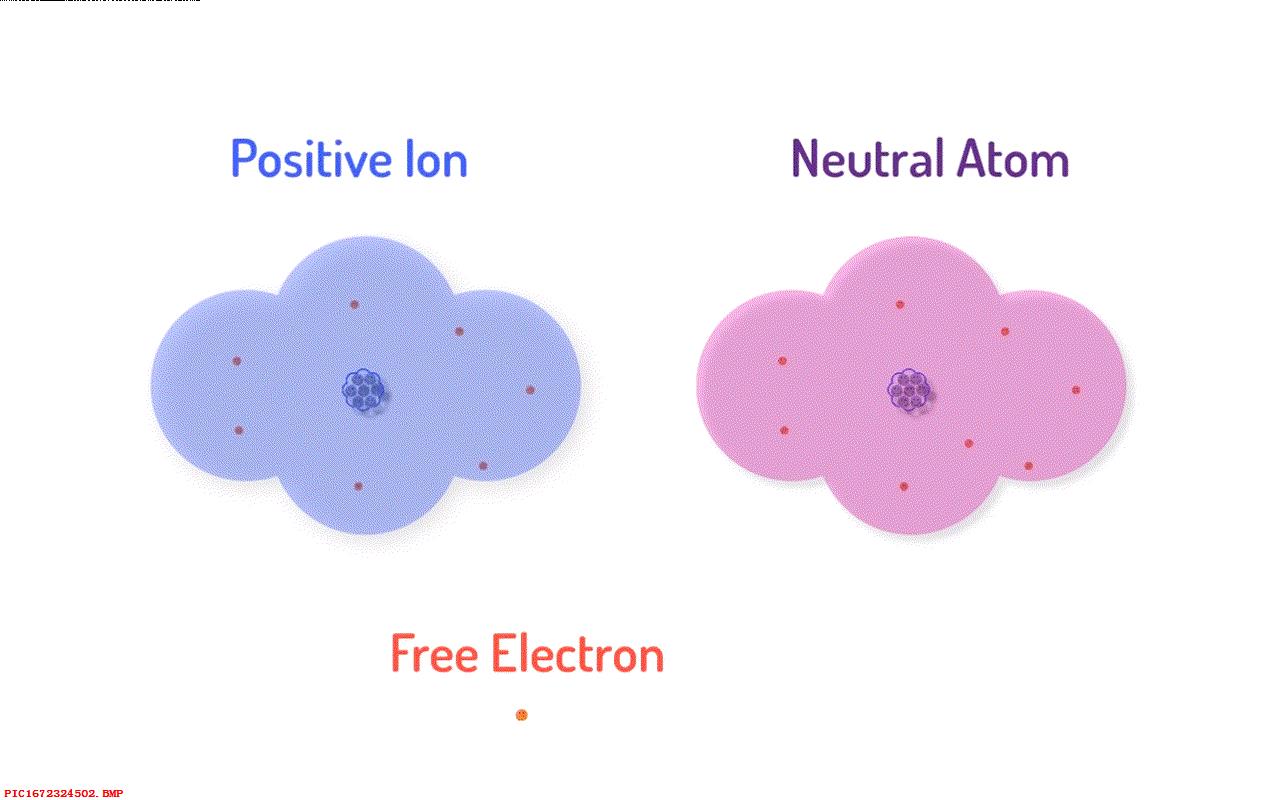
三、电流
电流是由流动的电子形成,这是电流的定义。 单个电子运动的速度实际上并不快,但可以形成在同一方向运动的电子同时流动。 在金属中有很多自由电子和离子。电子可以在离子之间比较容易的穿行,这种物质成为导体。 塑料中则几乎没有自由电子和离子,所以电很难通过它们,它们被称为绝缘体。 在普通的电线中,内部的金属可以让电通过,外部的绝缘保护层则防止电流到外边,比如你的手上。
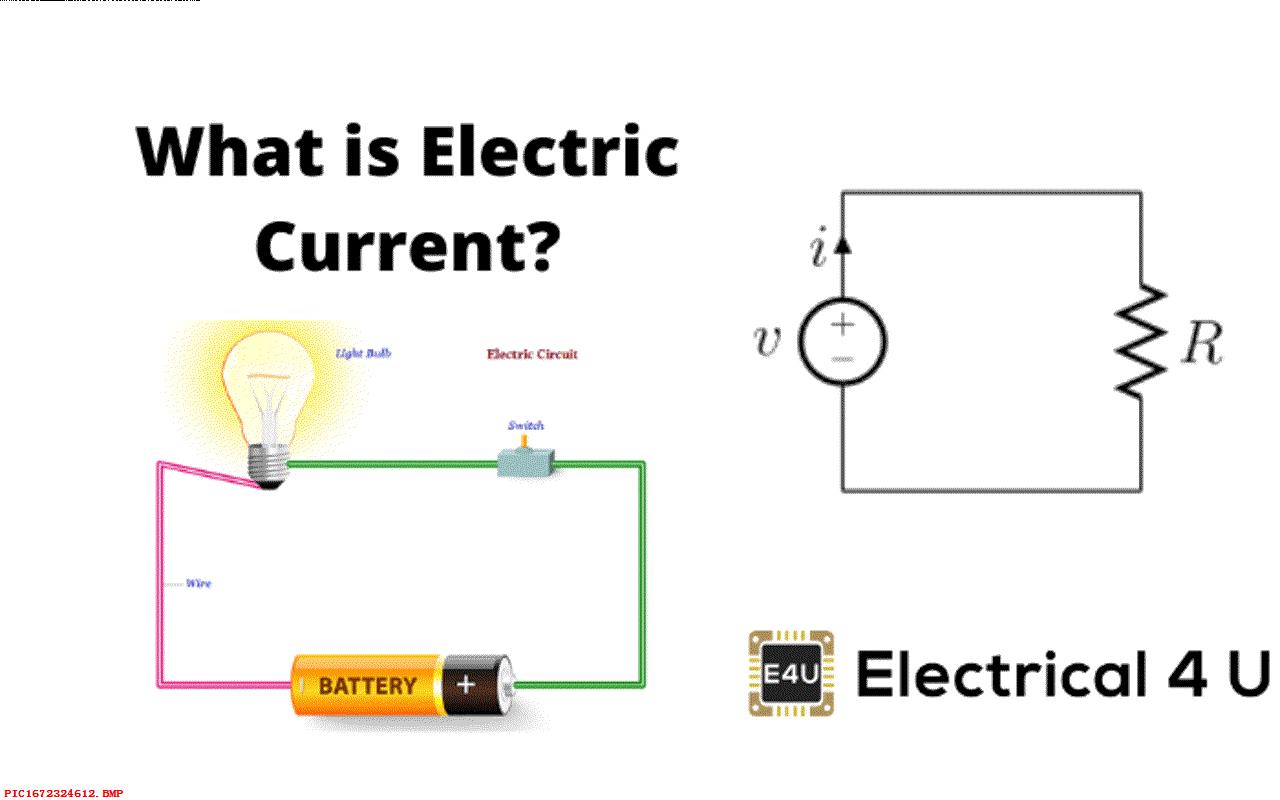
那么如何让电子在金属中移动呢?只需要一个电池就可以了。 任何电池都有一个正极和负极。在负极上会聚集大量的电子,正极则有大量的离子。 异性相吸、同性相斥,所以负极的电子就会被排斥出负极流向被吸引的正极。 如果外部使用了电线将电池负极与正极相连,那么电子就可以通过电线流向正极。

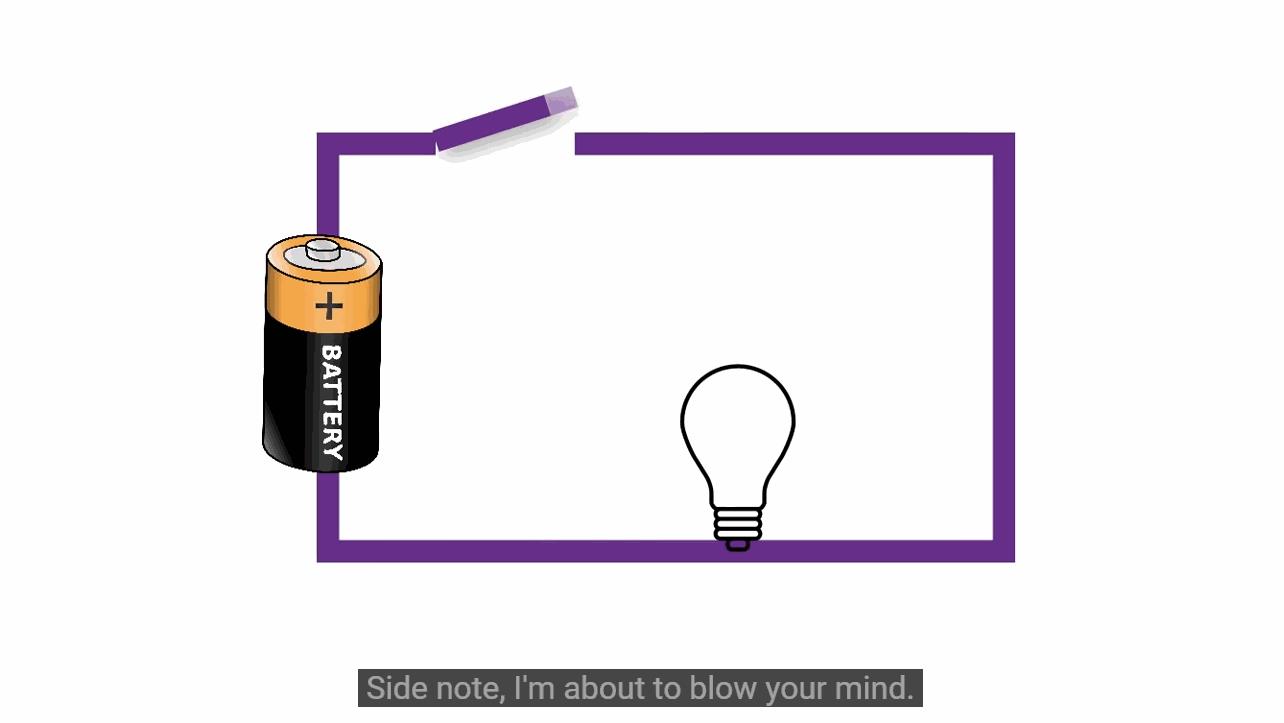
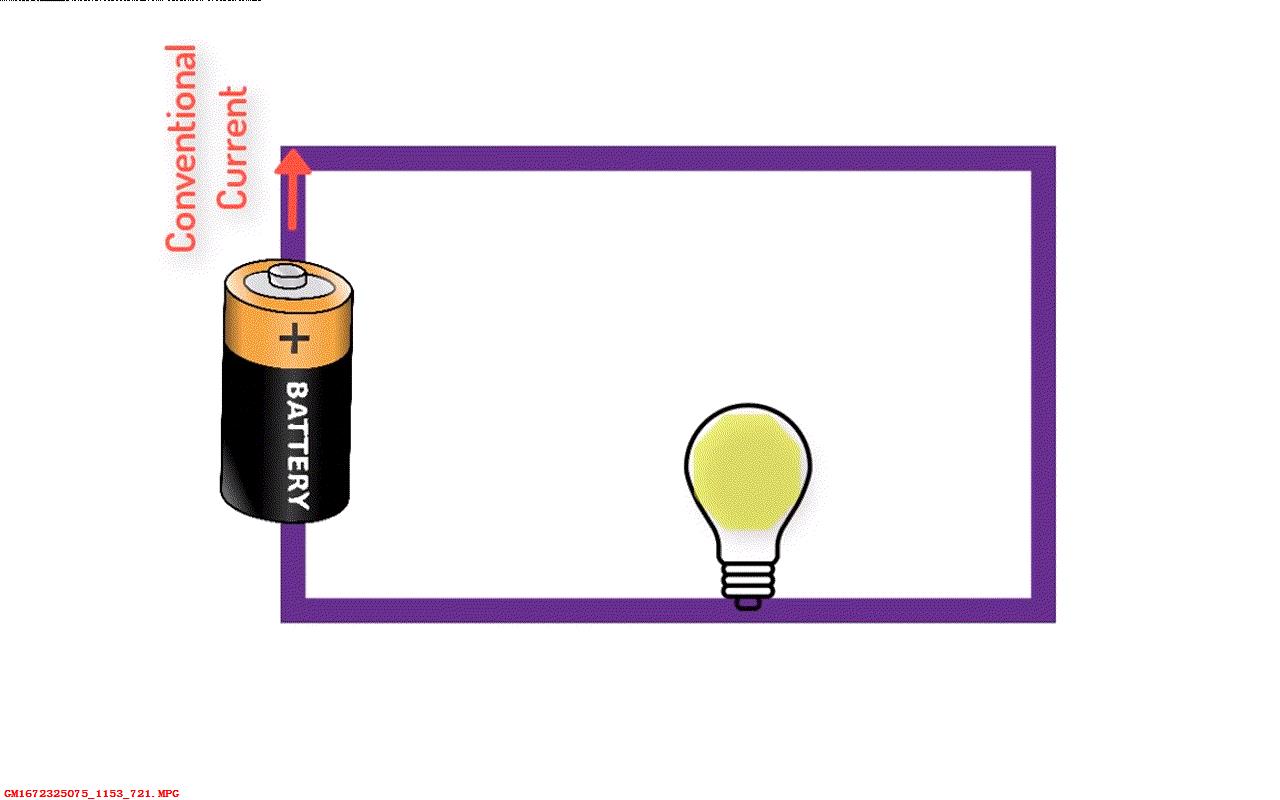
▲ 图1.2.2 电流流动的错误想法
顺便说一下一个打破传统观念的事实。通常情况下我们都认为电流是从电池的正极流向负极。 这个说法源自于富兰克林对于正电荷与负电荷的定义。 在1745年由于他任意定义并坚持认为在放电中电从正极流向了负极。 此后过了150年之后人们才发现了电子的存在,那个时候我们已经建立了相应的设备、教学、规则里都认为电流从正极流向负极。 所以为了不将所有的设备和规则改变,所以不再考虑实际情况。
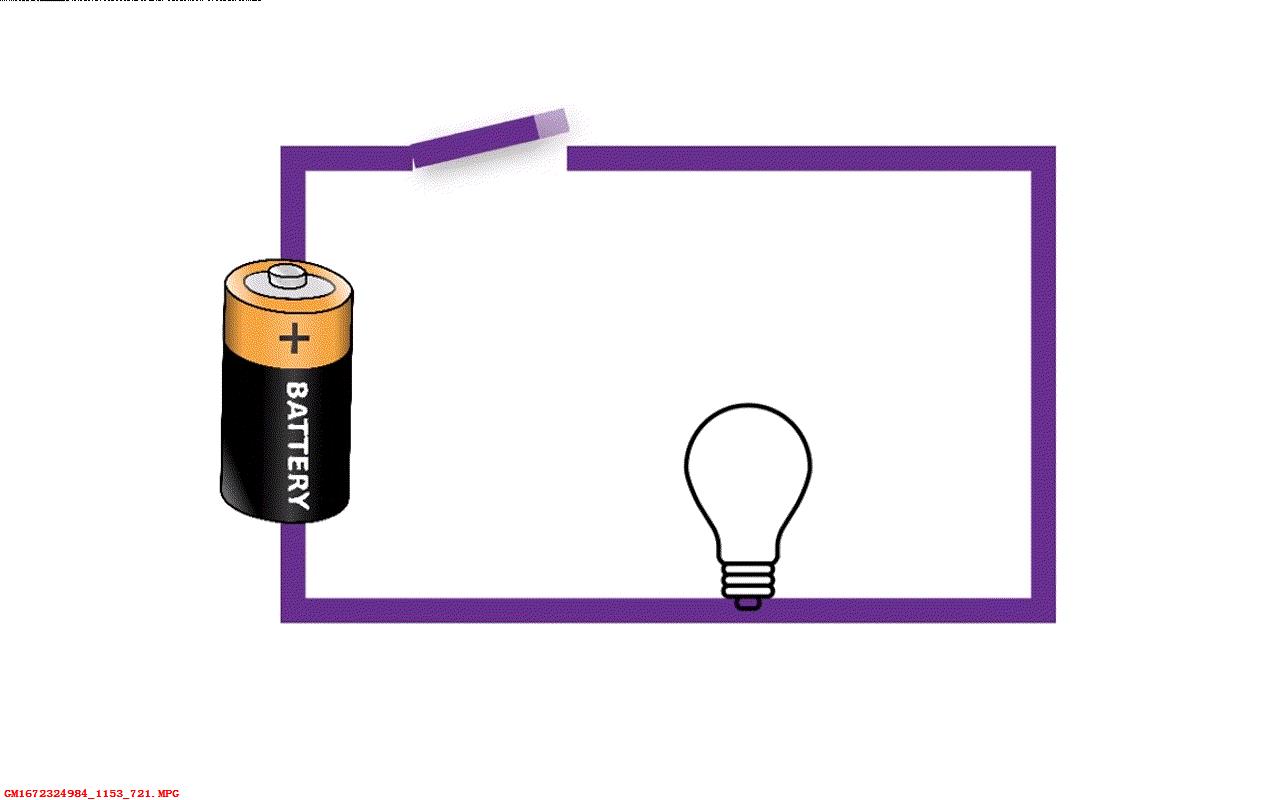
每当我们讲到电流流动方向,实际中是带负电荷的电子沿着相反的方向流动。可以说不管是有意无意,所有的世界上所有科学教师和电子工程师都在维护着一个共同的谎言。 真的不可思议,对吧?
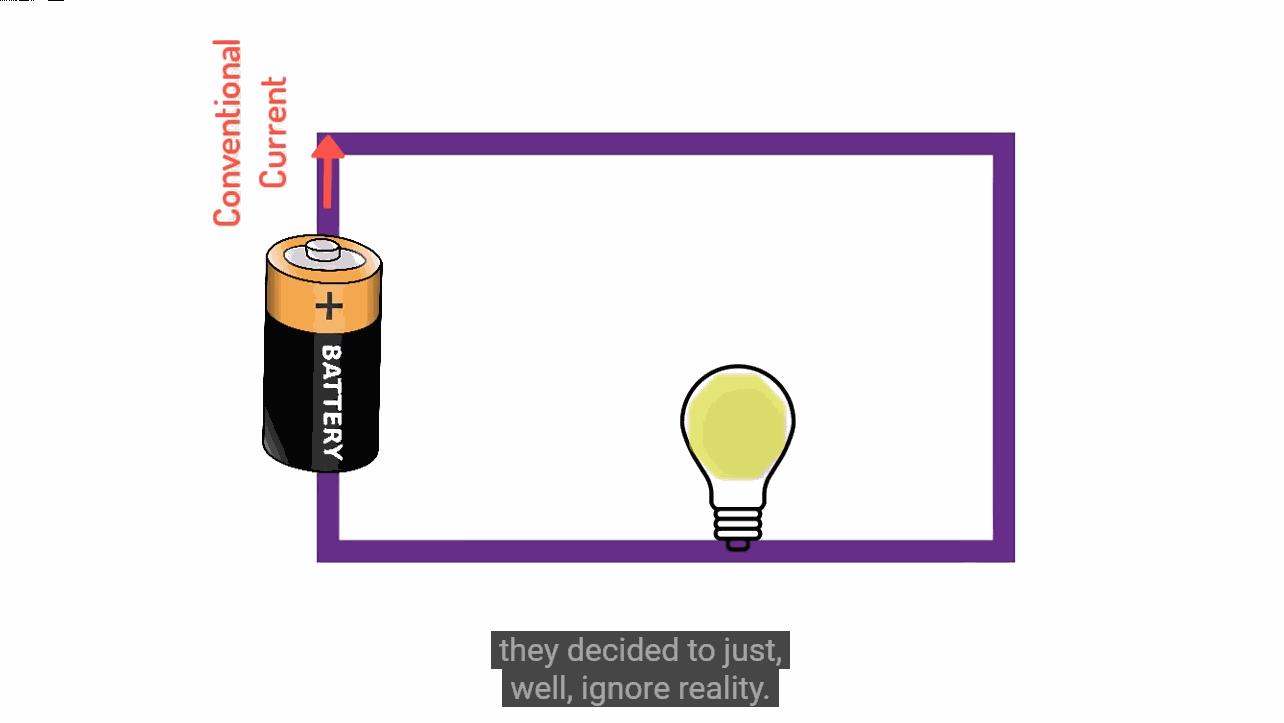
▲ 图1.3.2 电流流动的实际情况
四、电池
但是到此为止,电池是如何工作的还没有讨论。 电池究竟如何产生并维持电极的正和负的呢? 每个电池都利用了两种金属与酸性或者碱性物质之间的化学反应。 酸倾向于移动电子,碱则与移动的离子反应。 这样就使得反应的金属要么带有过量的电子形成负极,或者失去电子形成正极。
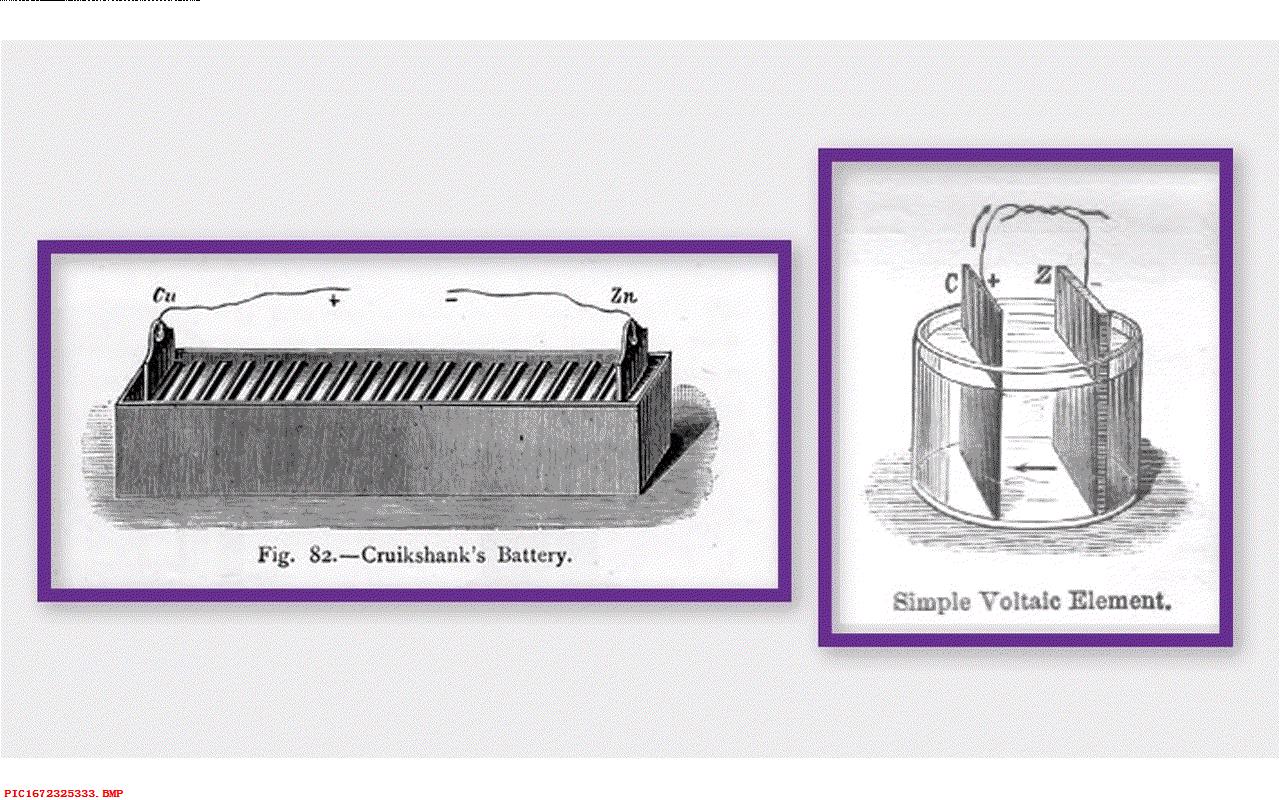
最早的电池是在1800年建造的,是将银片和锌片放在装满盐水的杯子里 。盐水在这里充当酸性物质。这就形成一个比较弱的电池。 其中盐与锌反应,增加了了电子形成了负极。与银反应移除了电子形成了正极。


▲ 图1.4.1 1800年的伏打电池
很快人们使用了不同的金属片浸泡在酸液中制作了电池。 现在汽车上的铅酸电池是由铅和氧化铅浸泡在硫酸液中构成的。
由于酸不是一个很方便使用的化学物质, 酸很容易将外部容器进行腐蚀,酸液也容易泼洒。 在1899年人们开始使用碱性物质来替代电池中的酸液。
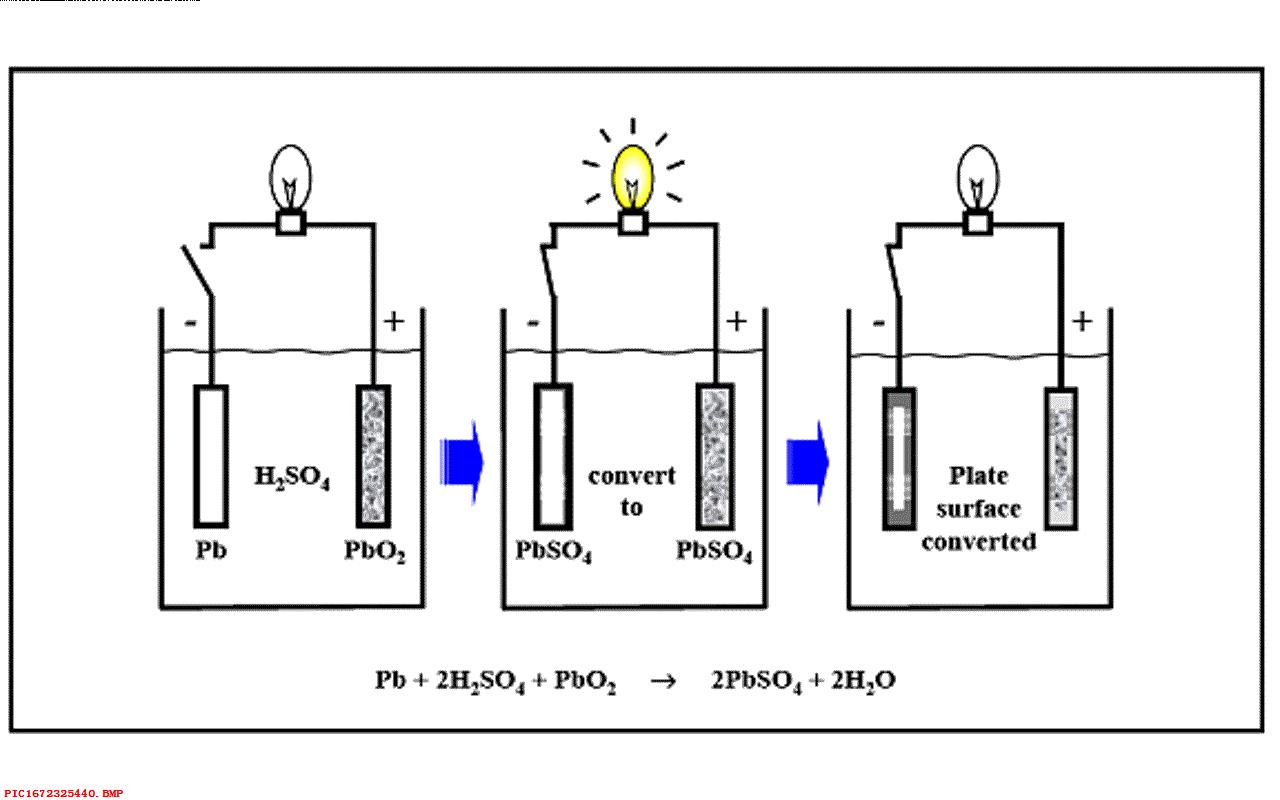
五、碱性电池
当代大部分的电池都使用碱替代酸来组成电池。今天有很多种类的电池。 下面让我们看一下碱性电池的结构。 化学中的物质往往有很多别名,比如酸碱反应中的碱性物质被称为 base, alkeline等。这一点会把人逼疯了。

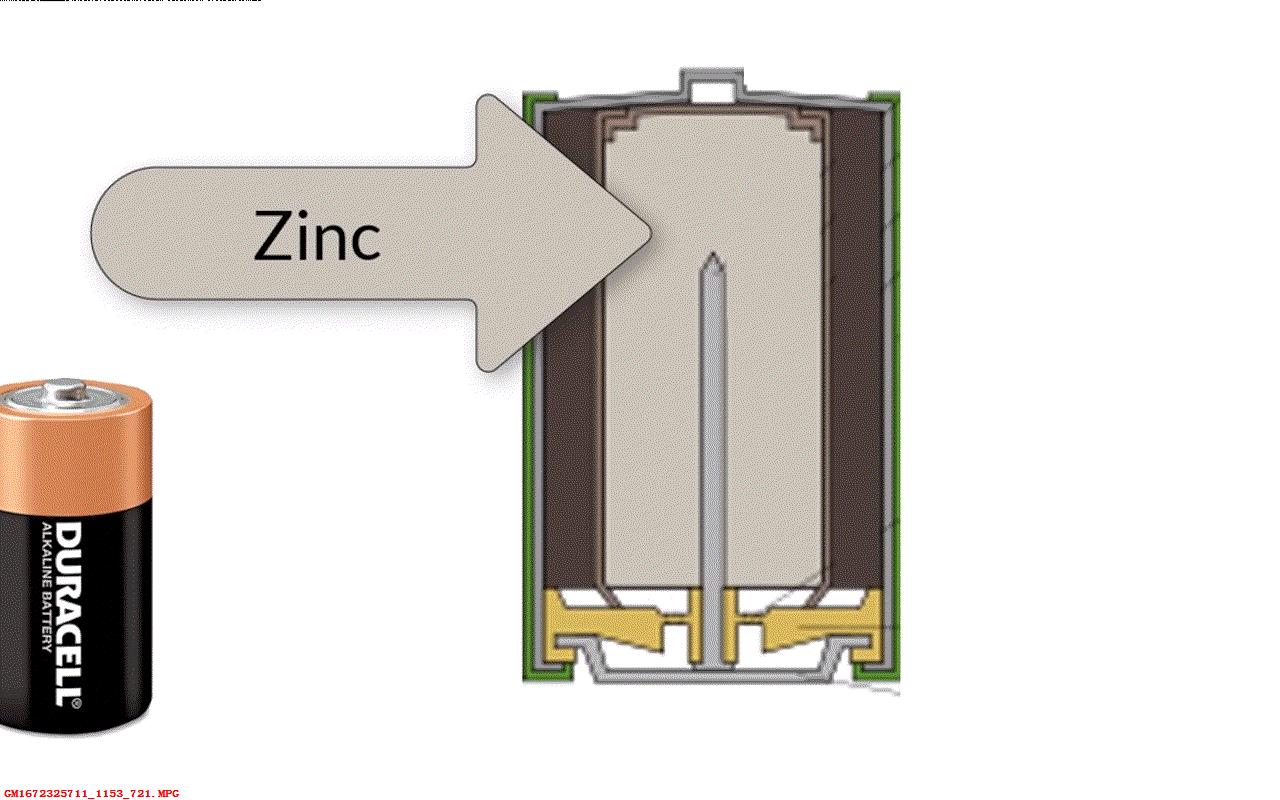
碱性电池有很多规格具有不同的形状河池尺寸。 但内部具有相同的金属参与相同的化学反应。下面展示一个典型碱性电池内部的结构。


▲ 图1.5.1 碱性电池结构
在电池中心有金属锌与一些碱性物质混合,比如氢氧化钾。 外围是氧化锰,氢氧化钾与金属锌反应,但其中带正电荷的离子移动出来,剩下多余的带负电荷的电子。 接下来化学物质又和氧化锰反应,增加很多离子,于是形成过量的带正电荷的离子。 锌与氧化锰被一层塑料隔离,所以电子不会流入正极并与离子结合。 电子聚集并相互排斥,最终汇聚在中间集电金属棒上。这个反应在两边持续一直到形成了很强的电动势,化学反应才停止。
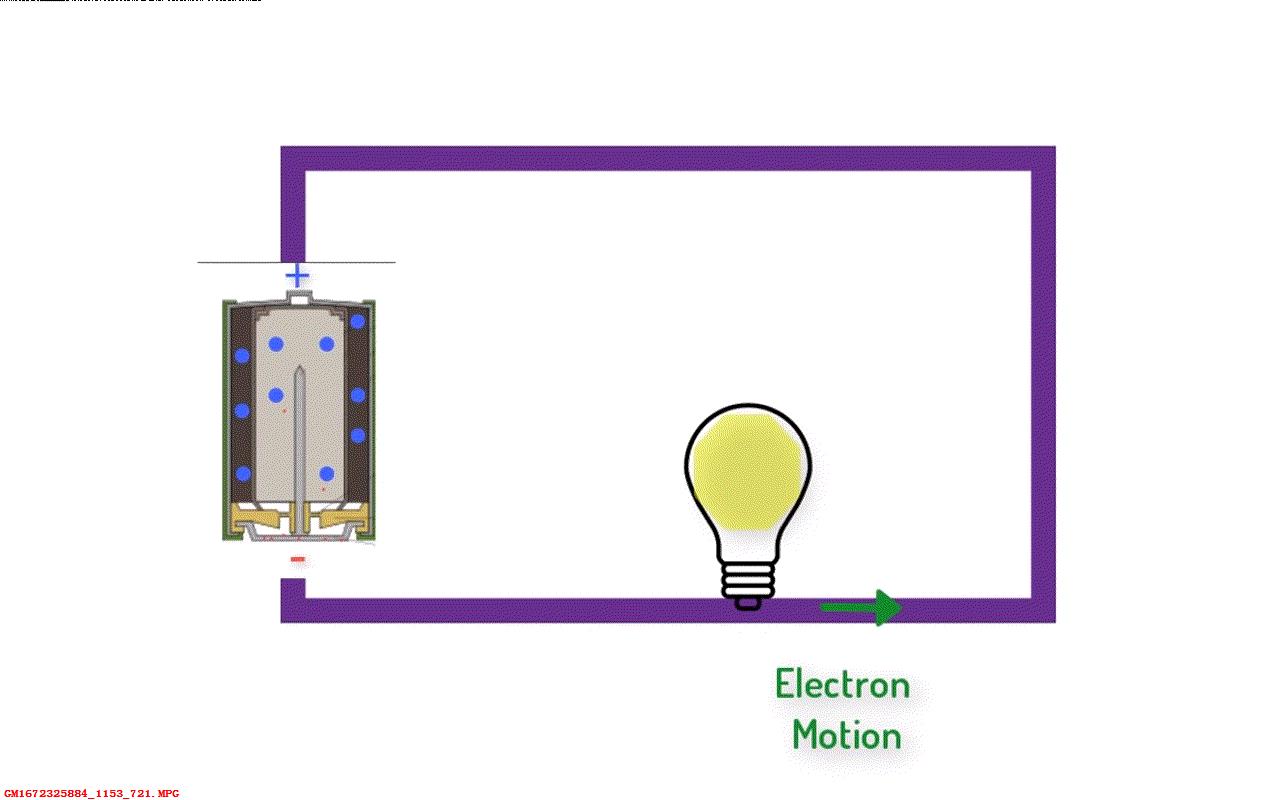
常见到的AA碱性电池的电压为1.5V。当电池接入电路回路中,电子从负极
触发沿着导线流向电池的正极,化学反应又重新开始了,维持内部电动势为1.5V。

▲ 图1.5.2 电路中的电池
经过化学物质与金属反应,逐步化学物质变得越来越弱,最终失去了反应的能力。 锌中的离子消耗干净之后,电池就报废了。
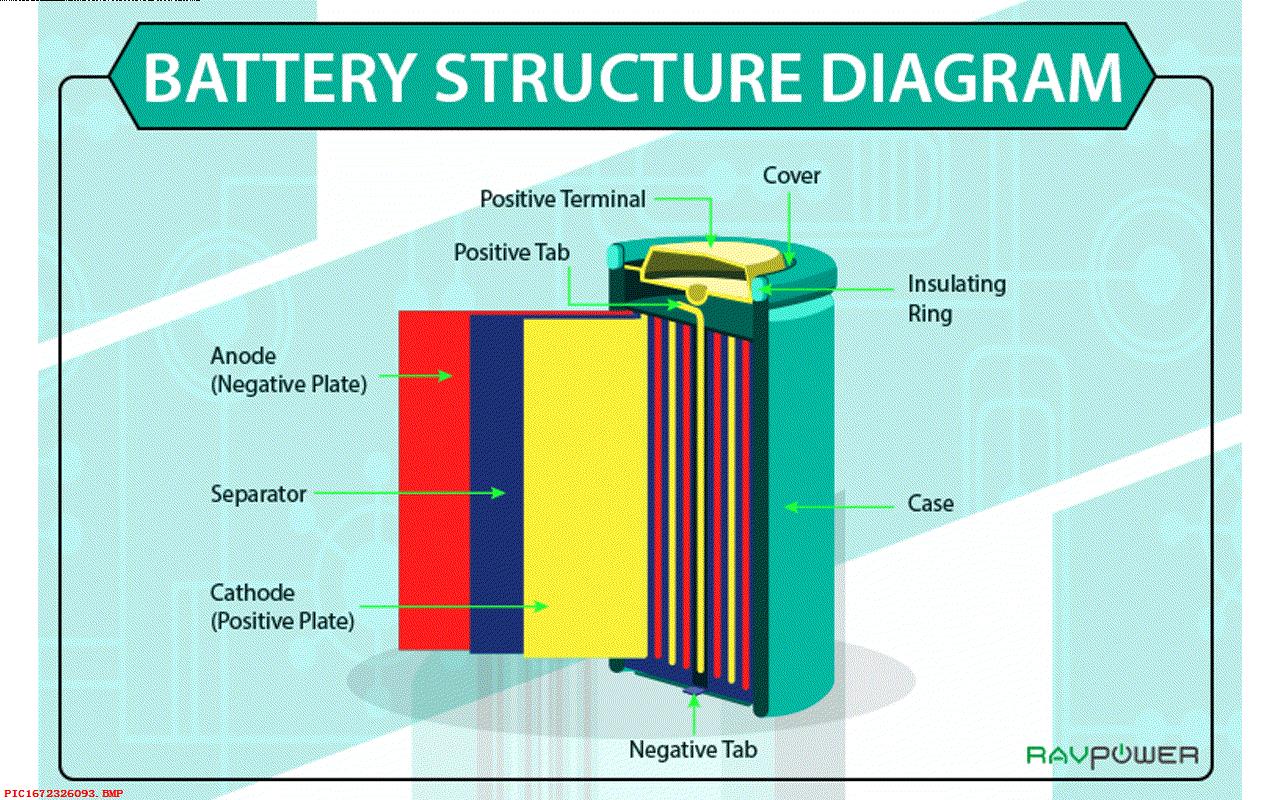
六、充电电池
碱性电池是一次性电池,不能够反复充电。能够充电电池的工作原理也是类似的。 通过化学反应移动相应的离子和电子。正极带有更多的离子,负极带有更多的电子。 当电流反向流动的时候,充电电池内部的化学反应就反向进行。 对应的离子回到了原来的金属里面,碱或者酸性物质逐步增强。

不同的电池有着不同的结构、化学反映物质以及不同的金属。 但都包含酸或者碱,两种不同的金属或者金属化合物,使得一边带有多余的负电荷电子,一边带有多余的正电荷离子。 这就是电池工作原理。
这里面的化学过程很简单, 是吧。
■ 相关文献链接:
● 相关图表链接:
- 图1.1.1 不同的电池
- 图1.1.2 原子钟的原子核以及外部的电子云
- 图1.2.2 电流流动的错误想法
- 图1.3.2 电流流动的实际情况
- 图1.4.1 1800年的伏打电池
- 图1.5.1 碱性电池结构
- 图1.5.2 电路中的电池
以上是关于电池工作原理:一种通俗易懂的讲解的主要内容,如果未能解决你的问题,请参考以下文章